SOLID STATE
·
क्रिस्टलीय ठोस के गुण (Properties of Crystalline Solids):
o
अक्रिस्टलीय ठोस (Amorphous solids) के
गुण:
·
क्रिस्टलीय ठोसों का वर्गीकरण (Classification of Crystalline
Solids):
o
(1) आण्विक
ठोस (Molecular
Solids)
o
(क) अध्रुवी आण्विक ठोस (Non-polar Molecular solids)
o
(ख) ध्रुवीय आण्विक ठोस (Polar Molecular Solids)
o
(ग) हाइड्रोजन आबंधित आण्विक ठोस (Hydrogen bonded Molecular Solids)
·
(2)
आयनिक ठोस (Ionic Solids)
·
(3) धात्विक
ठोस (Metallic Solid)
·
(4) सहसंयोजक अथवा नेटवर्क ठोस (Covalent or Network Solids)
o
सहसंयोजक अथवा नेटवर्क ठोस (Covalent or Netwok solids) के गुण:
·
वे पदार्थ जिनका निश्चित आकार, सपष्ट सीमा, स्थिर आयतन होता है
उन्हें ठोस कहते हैं.ठोस पदार्थों में उच्च यंग मापांक और अपरूपता मापांक होते है।
इसके विपरीत, ज्यादातर
तरल पदार्थ निम्न अपरूपता मापांक वाले होते हैं और श्यानता का प्रदर्शन करते हैं।
·
भौतिक विज्ञान की जिस शाखा में ठोस का अध्ययन करते हैं, उसे ठोस-अवस्था
भौतिकी कहते हैं। पदार्थ विज्ञान में ठोस पदार्थों के भौतिक और रासायनिक गुणों और
उनके अनुप्रयोग का अध्ययन करते हैं। ठोस-अवस्था रसायन में पदार्थों के संश्लेषण, उनकी पहचान और
रासायनिक संघटन का अध्ययन किया जाता है।
- प्रत्येक ठोस अवयवी कणों से मिलकर बनता है। ये अवयवी कण अणु , परमाणु या
आयन होते है। ये closely packed(अच्छे से दबाकर पैक किया हुआ) अर्थात निबिड
संकुलित होते है तथा असंपीडिय होते है अतः ठोस कठोर होते हैं।
- ठोस के अवयवी कणों के मध्य रिक्त स्थान कम होता है। इनकी स्थिति स्थिर बनी रहती हैं अतः ठोस का
आयतन निश्चित बना रहता है।
- इनका घनत्व गैस तथा द्रव की तुलना में अधिक होता है। (d =M/V)
- इनका गलनांक प्राय: अधिक होता है।
- ये माध्य स्थिति के सापेक्ष दोलन करते है।
ठोस दो प्रकार के होते है
- क्रिस्टलीय ठोस
- अक्रिस्टलीय ठोस
क्रिस्टलीय ठोस के गुण (Properties
of Crystalline Solids):
- क्रिस्टलीय ठोस का melting point
(गलनांक) निश्चित
होता है।
- क्रिस्टलीय ठोस Anisotropic (विषमदैशिक) होते हैं। अर्थात उनके कुछ physical
properties (भौतिक गुणों),
यथा electrical resistance (विद्युत
प्रतिरोधकता), refractive index (अपवर्तनांक), आदि
भिन्न भिन्न दिशाओं में भिन्न भिन्न होते हैं। ऐसा भिन्न भिन्न दिशाओं में क्रिस्टलीय
ठोस के अलग अलग व्यवस्था के कारण होता है।
- क्रिस्टलीय ठोस को
तेज धार वाले औजार से काटने पर इसके दो भागों में विभक्त टुकड़ों की सतहें
सपाट तथा चिकनी होती हैं।
- क्रिस्टलीय ठोस का heat of
fusion ( गलन की उष्मा ) निश्चित तथा अभिलाक्षणिक होती है।
- क्रिस्टलीय ठोस
वास्तविक ठोस पदार्थ होते हैं
अक्रिस्टलीय ठोस (Amorphous solids) के गुण:
- Amorphous solid ताप के
एक निश्चित परास (A range of temperature) पर नरम
हो जाते है,
इसी कारण Amorphous solid (अक्रिस्टलीय
ठोस) को गलाकर साँचे में ढ़ाला जा सकता है,
जैसे कि प्लास्टिक, काँच, आदि।
- गर्म करने पर एक
निश्चित ताप पर Amorphous
solid क्रिस्टलीय बन जाते हैं। अक्रिस्टलीय ठोस के
क्रिस्टलीय बन जाने के कारण ही प्राचीन सभ्यता की कुछ काँच के बने वस्तुओं
में दुधियापन पाया जाता है।
- अक्रिस्टलीय पदार्थ
में तरल की भाँति प्रवाह प्रवृति होती है। हालाँकि अक्रिस्टलीय ठोस में
प्रवाह की प्रवृति बहुत ही slow होती है। अक्रिस्टलीय पदार्थ के प्रवाह की
प्रवृति के कारण ही बहुत पुराने इमारतों के खिड़कियों आदि में लगे काँच की जड़े
ऊपर की अपेक्षा थोड़ा मोटे हो जाते हैं।
- अक्रिस्टलीय ठोस की
प्रकृति Isotropic
(समदैशिक) होती है,
क्योंकि उनमें दीर्घ परासी व्यवस्था (long
range order) नहीं होती है, तथा सभी
दिशाओं में irregular
(अनियमित) arrangement (विन्यास) होता है।
- अक्रिस्टलीय ठोस
दैनिक जीवन में काफी उपयोगी हैं, यथा silicon, जो कि एक
अक्रिस्टलीय ठोस है,
सूर्य के प्रकाश के विद्युत रूपांतरण करने के लिए
उपलब्ध श्रेष्टतम photovoltaic
पदार्थ है।
·
क्रिस्टलीय तथा अक्रिस्टलीय ठोसों में अंतर:
·
|
गुण |
क्रिस्टलीय
(Crystalline) |
अक्रिस्टलीय
(non crystalline) |
|
1. ज्यामितीय
आकार |
इनका ज्यामितीय आकार निश्चित होता
है। |
इनका ज्यामितीय आकार निश्चित नहीं
होता। |
|
2. अवयवी
कणों की व्यवस्था |
परासी
व्यवस्था होती होती है। |
परासी
व्यवस्था होती होती है |
|
3. प्रकृति |
ये
वास्तविक ठोस है। |
ये आभासी
ठोस या अतिशीतित द्रव है। अर्थात
द्रवों के भाँति बहने वाले। |
|
4. गलनांक |
इनका
गलनांक निश्चित होता है। |
इनका
गलनांक निश्चित नहीं होता ये एक ताप परास पर धीरे धीरे पिघलते है। |
|
5. गलन
ऊष्मा |
गलन
ऊष्मा निश्चित होती है। |
गलन
ऊष्मा निश्चित नहीं होती। |
|
6. विदलन
गुण |
तेज धार
वाले औजार से काटने पर ये सपाट व चिकनी सतह वाले दो भागो में विभक्त हो जाते है। |
तेजधार
वाले औजार से काटने पर ये समान व चिकनी सतह वाले दो भागो में विभक्त नहीं होते
है। |
|
7. दैशिकता |
ये विषम
दैशिक होते है। उदाहरण :
पोटेशियम नाइट्रेट , बेन्जोइक
अम्ल , कॉपर , चाँदी , लोहा , सोना , नैफ्थलीन , क्वार्ट्ज़ आदि |
ये सम
दैशिक होते है। उदाहरण :
काँच , लकड़ी , रबड़ , PVC (पोलीविनाइल क्लोराइड) , टेफ्लॉन , रेशा कांच , फाइबर आदि |
क्रिस्टलीय ठोसों का वर्गीकरण (Classification
of Crystalline Solids):
क्रिस्टलीय ठोसों को उनमें
परिचालित अंतराण्विक बलों (operating intermolecular forces) के आधार पर चार भागों
में बाँटा जा सकता है। ये हैं: आण्विक ठोस (Molecular Solids), आयनिक ठोस (Ionic
solids), धात्विक
ठोस (Metallic solids) तथा सहसंयोजक ठोस (Covalent or Network solids)।
(1) आण्विक ठोस (Molecular Solids)
वैसे क्रिस्टलीय ठोस जिनके अवयवी
कण अणु (Molecule) होते हैं, को आण्विक ठोस (Molecular
Solid) कहा
जाता है। Molecular solids को पुन: तीन भागों में बाँटा जा सकता है। ये हैं:
अध्रुवी आण्विक ठोस (Non-polar Molecular solids), ध्रुवीय आण्विक ठोस (Polar
Molecular Solids), तथा हाइड्रोजन आबंधित आण्विक ठोस (Hydrogen bonded
Molecular Solids)।
(क) अध्रुवी आण्विक ठोस (Non-polar Molecular solids)
परमाणुओं, यथा निम्न ताप पर
आर्गन और हीलियम अथवा Non-polar bond से बने अणुओं, यथा निम्न ताप पर H2, Cl2 और I2 द्वारा बने ठोस को
अध्रुवीय आण्विक ठोस कहा जाता है।
अध्रुवीय ठोस के परमाणु अथवा अणु
Weak Dispersion Forces (दुर्बल परिक्षेपण बलों) या London
Forces (लंडन
बलों) द्वारा बँधे रहते हैं।
अध्रुवीय ठोस के गलनांक निम्न होते हैं
तथा ये सामान्यत: कमरे के ताप और दाब पर द्रव अथवा गैसीय
अवस्था में रहते हैं।
ख) ध्रुवीय आण्विक ठोस (Polar
Molecular Solids)
वैसे
क्रिस्टलीय ठोस जिनके अणु अपेक्षाकृत प्रबल dipole-dipole interactions (द्विध्रुव-द्विध्रुव
अन्योन्यक्रियाओं) द्वारा एक दूसरे से बंधे होते हैं, ध्रुवीय आण्विक ठोस (Polar
Molecular Solids) कहलाते हैं। यथा HCl, SO2, SO2, NH3 आदि पदार्थ के अणु
ध्रुवीय सहसंयोजक बंधों से बने होते हैं, अत: ये ध्रुवीय
आण्विक ठोस कहलाते हैं।
ध्रुवीय आण्विक ठोस के melting
point (गलनांक)
अध्रुवीय आण्विक ठोस से अधिक होते हैं, फिर भी इनमें से
अधिकतर कमरे के ताप और दाब पर गैस अथवा द्रव होते हैं।
(ग) हाइड्रोजन आबंधित आण्विक ठोस (Hydrogen
bonded Molecular Solids)
ऐसे
क्रिस्टलीय ठोस, जिनके
अणुओं में H, और F, O अथवा N परमाणुओं
के मध्य ध्रुवीय-सहसंयोजक बंध होते हैं, को हाइड्रोजन आबंधित
आण्विक ठोस कहलाते हैं। ऐसे ठोस के अणुओं को प्रबल हाइड्रोजन आबंधन बंधित करते हैं, जैसे कि H2O (बर्फ)। हाइड्रोजन
आबंधित आण्विक ठोस विद्युत के अचालक होते हैं। सामान्यत: यह कमरे के ताप और दाब पर
वाष्पशील द्रव अथवा मुलायम ठोस होते हैं।
(2) आयनिक ठोस (Ionic
Solids)
वैसे ठोस जिनके Constituent
particles (अवयवी
कण) आयन होते हैं, आयनिक
ठोस (Ionic Solid) कहलाते हैं।
आयनिक ठोसों (Ionic
Solids) का
निर्माण positively charged ions [Anions (धनायनों)] तथा negatively
charged ions [Cations (ऋणायनों)] के three dimensional (त्रिआयामी) विन्यासों
में strong स्थिर वैद्युत (कूलॉमी) बलों से बंधने पर होता है।
आयनिक
ठोस कठोर और भंगुर प्रकृति के होते हैं।
आयनिक ठोस के Melting
point (गलनांक)
और Boiling point (क्वथनांक) उच्च होते हैं। चूँकि आयनिक ठोस में आयन गमन
के लिए स्वतंत्र नहीं होते हैं, अत: ये ठोस अवस्था में
विद्युतरोधी होते हैं। आयनिक ठोस गलित अवस्था में अथवा जल में घोलने पर, आयन गमन के लिए मुक्त
हो जाते हैं तथा वे विद्युत का संचालन करते हैं। अर्थात आयनिक ठोस, ठोस अवस्था में
विद्युत के कुचालक तथा गलित अवस्था तथा जल के विलयन में विद्युत के सुचालक होते
हैं।
(3) धात्विक ठोस (Metallic
Solid)
धातु, धात्विक ठोस कहलाते
हैं। धात्विक ठोस के अवयवी कण धनायन होते हैं। वास्तव में धातुएं मुक्त इलेक्ट्रॉन
से धिरे और उनके द्वारा संलग्नित धनायनों का व्यवस्थित संग्रह हैं। ये इलेक्ट्रॉन
निरंतर गतिशील होते हैं तथा क्रिस्टल में सर्वत्र समरूप से विस्तारित होते हैं।
धात्विक ठोस के ये मुक्त और
गतिशील इलेक्ट्रॉन ही धातुओं की उच्च वैद्युत और उष्मीय चालकता के लिये उत्तरदायी
होते हैं। जब धातुओं में विद्युत धारा प्रवाहित की जाती है, तो ये इलेक्ट्रॉन
धनायनों के नेटवर्क में सतत प्रवाह करते हैं तथा विद्युत धारा प्रवाहित होने लगती
है। उसी प्रकार धातु के एक भाग में उष्मा प्रदान की जाती है तो इसमें वर्तमान
मुक्त तथा गतिशील इलेक्ट्रॉन उस उष्मीय उर्जा को धातु के पूरे भाग में समान रूप से
विस्तारित कर देती है।
धातुओं की विशेष चमक भी उनमें
उपस्थित मुक्त तथा गतिशील इलेक्ट्रॉन के कारण ही होती हैं। धातुएँ अत्यधिक
अधातवर्धनीय (malleable) तथा तन्य (ductile) होती हैं।
(4) सहसंयोजक अथवा नेटवर्क ठोस (Covalent
or Network Solids)
अधात्विक क्रिस्टलीय ठोस, जिनके संपूर्ण
क्रिस्टल में निकटवर्ती परमाणुओं के बीच सहसंयोजक बंध बनने के कारण विस्तृत अनेकरूपता
होती है, सहसंयोजक
अथवा नेटवर्क ठोस कहलाते हैं।
सहसंयोजक अथवा नेटवर्क ठोस (Covalent
or Netwok solids) को Giant Molecule (विशाल अणु) भी कहा जाता है।
सहसंयोजक अथवा नेटवर्क ठोस (Covalent
or Netwok solids) के परमाणुओं के बीच सहसंयोजक बंध दिशात्मक (Directional)
प्रकृति
के होते हैं, इसलिये
परमाणु अपनी स्थितिओं पर अति प्रबलता से संलग्न रहते हैं।
सहसंयोजक अथवा नेटवर्क
ठोस (Covalent or Netwok solids) के गुण:
सहसंयोजक अथवा नेटवर्क ठोस (Covalent
or Netwok solids) अति कठोर तथा भंगुर होते हैं।
सहसंयोजक अथवा नेटवर्क ठोस (Covalent
or Netwok solids) का Melting point (गलनांक) काफी उच्च होता है तथा ये गलन से पूर्व विघटित
भी हो सकते हैं।
सहसंयोजक अथवा नेटवर्क ठोस (Covalent
or Netwok solids) विद्युतरोधी होते हैं, अर्थात विद्युत का
संचालन नहीं करते हैं।
Diamond (हीरा) तथा Silicon
carbide (सिलिकॉन
कार्बाइड) सहसंयोजक अथवा नेटवर्क ठोस (Covalent or Netwok solids) का एक विशिष्ट उदाहरण
है।
ग्रेफाइट भी सहसंयोजक अथवा
नेटवर्क ठोस (Covalent or Netwok solids) का एक उदाहरण है, परंतु अपवाद स्वरूप
ग्रेफाइट मुलायम तथा विद्युत का सुचालक है। ग्रेफाइट का यह अपवादी गुण उसकी
विशिष्ट संरचना के कारण होता है।
समदैशिकता व विषम दैशिकता ठोस तथा अतिशीतित द्रव | परिभाषा | उदाहरण
Table of Contents
·
सम दैशिकता
ठोस किसे कहते है – Samdaishikta Thos Kise kahte hai:
·
विषम दैशिक
ठोस किसे कहते है – Visham Daishik Kise Kahte Hai:
·
काँच को अतिशीतित द्रव क्यों कहते है ?
सम दैशिकता ठोस किसे कहते है –
ठोसों के भौतिक गुण जैसे
अपवर्तनांक विधुत व ऊष्मा की चालकता , यांत्रिक सामर्थ्य आदि के मान किसी ठोस में अलग
अलग दिशाओं से ज्ञात करने पर यदि ये मान समान आते है तो इन्हे सम दैशिक ठोस कहते है। और इस गुण को सम दैशिकता कहते है।
Note: अक्रिस्टलीय ठोस में अवयवी कण निश्चित क्रम में
नहीं होते अतः ये सम दैशिक है।
विषम दैशिक ठोस किसे कहते है –
ठोसों के भौतिक गुण जैसे अपवर्तनांक विधुत व ऊष्मा की चालकता , यांत्रिक सामर्थ्य आदि के मान
किसी ठोस में अलग अलग दिशाओं से ज्ञात करने पर यदि ये मान समान नहीं आते है तो
उन्हें विषम दैशिक ठोस कहते है इस गुण को विषम दैशिकता कहते है।
Note : क्वार्ट्ज़ , सिलिका का क्रिस्टलीय रूप है इसमें SiO44- की इकाइयां निश्चित क्रम में
व्यवस्थित रहती है जब क्वार्ट्ज़ को पिघलाकर ठंडा करते है तो यह कांच में बदल जाता
है इसमें SiO44- की इकाइयाँ नियमित क्रम में नहीं होती अतः कांच
अक्रिस्टलीय ठोस है।
काँच को अतिशीतित द्रव क्यों कहते है ?
कांच एक अक्रिस्टलीय ठोस है इसमें द्रवों की भांति बहने का गुण होता है जैसे
पुरानी इमारतों पर लगे शीशे निचे से मोठे व ऊपर से पतले हो जाते है।
क्रिस्टलीय ठोस के प्रकार | उदाहरण
Table of Contents
·
क्रिस्टलीय ठोस क्या है?
– Kristaliy Thos Kise Kahte Hai:
o
क्रिस्टलीय ठोस के प्रकार –
Kristaliy Thos Ke Prakar:
§
§ (1) धात्विक ठोस या धात्विक क्रिस्टल :
§ (2) सहसंयोजक ठोस या नेटवर्क ठोस :
§ 3. हाइड्रोजन बंध युक्त ठोस :
क्रिस्टलीय ठोस क्या है? –
इन ठोसो में अवयवी कणों (परमाणु, अणु और आयन) की एक निश्चित नियमित ज्यामितीय
व्यवस्था होती है,
जिसकी
बार-बार पुनरावृत्ति होने पर एक निश्चित ज्यामिति वाली त्रिविमीय संरचना का
निर्माण होता है।
हम कह सकते हैं कि क्रिस्टलीय ठोसो में दीर्घ परास क्रम होता है। इस तरह क्रिस्टलीय ठोस में बड़ी संख्या में इन्हें बनाने
वाली इकाई होती है जिन्हें क्रिस्टल कहा जाता है। अतः क्रिस्टल वे ठोस पदार्थ होते हैं जिनकी निश्चित
ज्यामिति आकृति समतल फलक एवं तीक्ष्ण किनारे होती है। क्रिस्टलीय ठोस वास्तविक ठोस के रूप में जाने जाते हैं।
उदाहरण –
सोडियम
क्लोराइड (साधारण नमक) सुक्रोज (शक्कर) हीरा क्वार्ट्ज ठोस धातुएं आदि।
क्रिस्टलीय ठोस के प्रकार –
अन्तराणविक बलों के आधार पर
क्रिस्टलीय ठोस चार प्रकारों में वर्गीकृत किया हैं।
1. धात्विक ठोस या
धात्विक क्रिस्टल
2. सहसंयोजक ठोस या
नेटवर्क ठोस
3. आयनिक ठोस
4. आण्विक ठोस
आण्विक ठोस 3 प्रकार के होते है |
- अध्रुवीय
ठोस
- ध्रुवीय
ठोस
- हाइड्रोजन
बन्ध युक्त ठोस
(1) धात्विक ठोस या धात्विक क्रिस्टल :
- इसमें धनायन ,इलेक्ट्रान
रूप समुद्र में डूबे रहते है।
- ये विधुत और ऊष्मा
के चालक होते है।
- ये कठोर तथा उच्च
गलनांक वाले होते है।
- ये अघात वर्धनीय
तन्य होते है।
- उदाहरण : सभी धातु जैसे cu , Al , Fe
, Ni , Cr , Mg .
(2) सहसंयोजक ठोस या नेटवर्क ठोस :
- इसमें परमाणुओं के
मध्य सहसंयोजक बंध पाया जाता है। ये परमाणु
परस्पर मिलकर विशेष अणु का निर्माण करते है।
- ये अत्यधिक कठोर व
उच्च गलनांक वाले होते है।
- ये ठोस तथा पिघली
हुई अवस्था में विधुत के कुचालक होते है।
- उदाहरण : हीरा , Sic (सिलिकॉन
काबोइड) , AlV (एल्युमीनियम
नाइट्राइड)
अपवाद
ग्रेफाइड : यह षट्कोणीय परतो के रूप में होता है ये परते एक दूसरे पर फिसलती
है अतः ग्रेफाइड नरम होता है इसमें स्वतंत्र इलेक्ट्रान होने के कारण यह विधुत का
सुचालक होता है।
(3) आयनिक ठोस :
- इनके अवयवी कण आयन
होते है।
- इनके आयनो के मध्य
प्रबल वैधुत आकृषण होता है अतः ये कठोर व उच्च गलनांक वाले होते है।
- ये भंगुर होते है।
- ये ठोस अवस्था में
विधुत के कुचालक परन्तु पिघली हुई अवस्था में विधुत के सुचालक होते है।
- उदाहरण : NaCl
, KCl , K2SO4 , NH4Cl , CaCl ,
FeCl3 आदि।
(4) आणविक ठोस :
इनके अवयवी कण अणु होते है ये 3 प्रकार के होते है।
1.
अध्रुवीय ठोस :
- इसके अणुओ के मध्य
लन्दन बल होते है।
- ये कमरे के ताप पर
गैस या द्रव होते है।
- ये विधुत के कुचालक
होते है।
- इनका गलनांक कम होता
है।
- ये मुलायम होते है।
- उदाहरण : I2 , Cl2 ,
C6H6 , CO2 आदि।
2.
ध्रुवीय ठोस :
- इनके अणुओ के मध्य
द्विध्रुव द्विध्रुव आकृषण होता है।
- ये कमरे के ताप पर
गैस या द्रव होते है।
- ये ठोस अवस्था में
विधुत के कुचालक होते है।
- उदाहरण : HCl
, SO2 आदि।
3.
हाइड्रोजन बंध युक्त ठोस :
- इनके अणुओ के मध्य
अंतरा अणुक हाइड्रोजन बंध होते है।
- ये विधुत के कुचालक
होते है।
- ये मुलायम होते है।
- उदाहरण : बर्फ।
क्रिस्टल जालक लक्षण व इकाई कोष्टिका | प्रकार
Table of Contents
·
क्रिस्टल
जालक की परिभाषा क्या है – crystal jal kise kahate hain:
§ इकाई कोष्टिका (unit
cell ) यूनिट सेल
:
§ इकाई सेल के पैरामीटर(parameters
of unit cell) :
§ यूनिट सेल के प्रकार(types
of unit cell ) :
§ (A) आद्य मात्रक कोष्ठिका (primitive
unit cell):
§ (B) केंद्रित मात्रक कोष्ठिका:
§ (2)
फलक
केंद्रित मात्रक कोष्ठिका (face centered unit cell) :
§ (3)
अन्तः
केंद्रित मात्रक कोष्ठिका (base centered unit cell) :
क्रिस्टल जालक की परिभाषा क्या है –
कोई भी क्रिस्टल अवयवी कणों से मिलकर बना होता है ये अवयवी कण परमाणु , अणु या आयन तीनों में से कुछ भी
हो सकते है ,
क्रिस्टल
में अवयवी कणों (परमाणु ,
अणु , आयन) की तीनो विमाओं में निश्चित
ज्यामिति व्यवस्था होती है।
”
क्रिस्टल
में अवयवी कणों की तीनो विमाओं में अर्थात त्रिविमीय व्यवस्था को क्रिस्टल जालक
कहते है।”
“त्रिविम आकाश में किसी क्रिस्टल
की इकाइयों की एक नियमित व्यवस्था होती है और क्रिस्टल में इकाइयों की इस नियमित
व्यवस्था को ही त्रिविम जालक या क्रिस्टल जालक कहा जाता है। ”
हम जानते है कि कोई भी क्रिस्टल परमाणु , अणु या आयन अवयवी कणों से मिलकर बने होते है , जब इन अवयवी कणों को आपस में रेखा
द्वारा जोड़ दिया जाता है या मिला दिया जाता है तो क्रिस्टल जालक का आरेख प्राप्त
होता है।
यदि कोई क्रिस्टल आयनों से मिलकर बना होता है अर्थात यदि किसी क्रिस्टल में
अवयवी कण आयन हो तो इसे आयनिक जालक कहते है।
यदि किसी
क्रिस्टल के परमाणु सहसंयोजक बंधो द्वारा बंधे हुए हो
तो उन्हें सहसंयोजक क्रिस्टल जालक कहते
है।ऊपर चित्र में दर्शाए अनुसार प्रत्येक अवयवी कण एक बिंदु द्वारा दर्शाया जाता
है जिसे जालक बिंदु या जालक स्थल कहते है।
किसी भी क्रिस्टल जालक में कई तल होते है अत: किसी क्रिस्टल जालक में बने तल
को क्रिस्टल तल कहते है।
यदि जालक के सभी अवयवी कणों को
सीधी रेखा द्वारा जोड़ा जाए तो इससे जालक की ज्यामिति प्रदर्शित होती है जैसे हमने
ऊपर कणों को आपस में जोड़ा है तो इससे एक ज्यामिति बन जाती है यह ही जालक की
ज्यामिति है।
कोई भी क्रिस्टल इसके अवयवी कणों
से मिलकर बना होता है और ये अवयवी कण परमाणु , अणु या आयन कुछ भी हो
सकते है , अर्थात
क्रिस्टल परमाणु , अणु
या आयन से मिलकर बना होता है इन्हें अवयवी कण कहते है।
क्रिस्टल जालक के लक्षण :
- क्रिस्टल जालक में
स्थित प्रत्येक बिंदु को जालक बिंदु कहते है।
- प्रत्येक जालक बिंदु
अणु-परमाणु या आयन को निरूपित करता है।
- जालक बिंदुओं को
सीधी रेखा से मिलाने पर क्रिस्टल जालक की ज्यामिति बनती हैं।
इकाई कोष्टिका (unit cell ) यूनिट सेल :
क्रिस्टल चालक की छोटी से छोटी
इकाई जिसकी बार बार पुनरावर्ती होती है उसे यूनिट सेल (unit
cell ) कहते
है।
इकाई सेल के पैरामीटर(parameters of unit cell) :
यूनिट सेल की पहचान 6 पैरामीटर से की जाती
है।
1. अक्षीय दूरी : इसे abc से व्यक्त करते है।
2. अक्षीय कोण : अक्षो
के मध्य बने कोण को अक्षीय कोण कहते है। इन्हे α
, β , γ से व्यक्त करते है।
यूनिट सेल के प्रकार(types of unit cell ) :
(A)
आद्य मात्रक कोष्ठिका (primitive unit cell):
इस मात्रक कोष्ठिका में घन के
आठों कोनों पर आठ परमाणु होते है।
यह यूनिट सेल एक परमाणु की बनी
होती है।
इसकी गणना निम्न प्रकार से की
जाती है।
कुल परमाणु की संख्या = कोनों पर
स्थित परमाणु 8 x 1/8 = 1
(B) केंद्रित मात्रक कोष्ठिका:
ये तीन प्रकार की होती है।
(1) अन्तः (काय )
केंद्रित मात्रक कोष्ठिका(body centered unit cell) :
इस unit
cell में
घन के आठों कोनो पर आठ परमाणु होते है। तथा घन के केंद्र में
एक परमाणु स्थित होता है।
यह यूनिट सेल दो परमाणुओं की बनी
होती है।
कुल परमाणुओं की संख्या = (कोनों
पर स्थित कुल परमाणु ) 8 x 1/8 + (काय केंद्रित परमाणु )
1 x 1
= 1 + 1 = 2
(2) फलक केंद्रित मात्रक कोष्ठिका (face
centered unit cell) :
इस यूनिट सेल में घन के आठों
कोनों पर आठ परमाणु होते है। तथा प्रत्येक फलक के
केंद्र में एक एक परमाणु स्थित होता है।
यह यूनिट सेल चार परमाणुओं की
बनी होती है इसकी गणना निम्न प्रकार से की जाती है।
कुल परमाणुओं की संख्या = (कोनों
पर स्थित कुल परमाणु ) 8 x 1/8 + (फलक केंद्रित परमाणुओं की संख्या ) 6 x
1/2
= 1 + 3 = 4
(3) अन्तः केंद्रित मात्रक कोष्ठिका (base
centered unit cell) :
घन के आठों कोनो पर आठ परमाणु
होते है तथा आमने सामने के दो फलको के केन्द्र में भी एक एक परमाणु स्थित होता है।
यह unit
cell दो
परमाणुओं से मिलकर बनी होती है इसकी गणना निम्न प्रकार से की जाती है।
कुल परमाणुओं की संख्या = 8 x
1/8 + 2 x 1/2
= 1 + 1
= 2
क्रिस्टल तंत्र | परिभाषा | प्रकार
क्रिस्टल तंत्र :
ब्रेवे के अनुसार 14
प्रकार के
क्रिस्टल जालक होते है तथा 7 क्रिस्टल तंत्र होते है।
|
क्रिस्टल तंत्र |
अक्षीय लम्बाई |
अक्षीय कोण |
क्रिस्टल जालक |
उदाहरण |
|
1. घनीय |
a = b =
c |
α = β =
γ = 90′ |
आद्य , अन्तः , फलक केंद्रित = 3 |
NaCl ,
ZnS |
|
2. द्वि समलम्बाक्ष या चतुष्कोणीय |
a = b ≠ c |
α = β =
γ = 90′ |
आद्य , अन्तः = 2 |
Sn ,
SnO2 , TiO2 |
|
3. विषम लंबाक्ष |
a ≠ b ≠ c |
α
= β = γ = 90 |
आद्य , अन्तः , फलक अन्तः = 4 |
विषम लम्बास , KnO3 , BaSO4 |
|
4. एकनताक्ष |
a ≠ b ≠ c |
α = β =
90′ , γ ≠ 90′ |
आद्य , अन्तः = 2 |
एकनताक्ष , गंधक , Na2SO4 |
|
5. षट्कोणीय |
a
= b ≠ c |
α = β =
90′ , γ = 120′ |
आद्य = 1 |
ग्रेफाइट |
|
6. त्रिसयनताक्ष |
a = b =
c |
α = β =
γ ≠ 90′ |
आद्य = 1 |
HgS ,
CaCO3 |
|
7. त्रिनताक्ष |
a ≠ b ≠ c |
α ≠ β ≠ γ ≠ 90′ |
आद्य = 1 |
CuSO4 .5H2O , K2Cr2O7 |
क्रिस्टलो में निबिड़ संकुलन क्या है
o
§
निबिड़ संकुलन क्या है:
परमाणु अणु आयन को गोलाकार माना जाता है ये इस प्रकार से व्यस्थित रहते है कि
इनके मध्य रिक्त स्थान कम से कम हो , इसे निबिड़ संकुलन कहते है।
क्रिस्टलों में निबिड़ संकुलन त्रिविमीय रूप से निम्न प्रकार से होता है।
1.
एक विमा में निबिड संकुलन :
इस
व्यवस्था में एक परमाणु दो परमाणुओं से स्पर्श
करता है अतः उपसहसंयोजन संख्या
2 होती
है।
2. द्विविमा में निबिड़ संकुलन :
यह दो
प्रकार से होता है।
- द्विविमा
में वर्ग निबिड़ संकुलन :
इस
व्यवस्था में उपसहसंयोजन संख्या 4 होती
है|
- द्विविमा
में षट्कोणीय निबिड़ संकुलन :
इस
व्यवस्था में उपसहसंयोजन संख्या 6 होती
है।
3. त्रिवीमा में निबिड़ संकुलन :
इसमें
तीन प्रकार की सरंचना बनती है।
|
BCC (body centered
cubic ) |
HCP (hexagonal close packed) |
FCC या CCP (face centered
cubic) |
|
1. केंद्रीय घनीय संरचना |
षट्कोणीय निबिड़ संकुलन |
घनीय निबिड़ संकुलन |
|
2. उपसहसंयोजन संख्या =8 |
12 |
12 |
|
3. कुल दक्षता = 68% |
74% |
74% |
|
4. रिक्त स्थान =32% |
26% |
26% |
|
X XXXXX |
इसे ABABAB संरचना भी कहते है। |
इसे ABCABCABC संरचना भी कहते है। |
FCC या CCP के लिए संकुलन दक्षता ज्ञात करना
दक्षता किसे कहते है:
एक आयाम रहित मात्रा जो कार्य की दक्षता को दर्शाती है। कार्य एक बल है जो कुछ
समय के लिए प्रक्रिया को प्रभावित करता है। बल की क्रिया पर ऊर्जा का व्यय होता
है। ऊर्जा को बल में निवेशित किया जाता है, बल को काम में लगाया जाता है, कार्य को प्रभावशीलता द्वारा
दर्शाया जाता है।
यूनिट सेल (unit
cell ) चार
परमाणुओं की बनी होती है।
कुल परमाणुओं की संख्या = (8 x
1/8) + (6 x 1/2) = 1+3 = 4
माना यूनिट सेल के किनारो की
लम्बाई = a
तथा परमाणु की त्रिज्या = r
ΔABC से
(AC)2 = (AB)2 + (BC)2
(AC)2 = a2 + a2
(AC)2 = 2 a2
AC = √(2 a2)
AC = √2 . a
चित्रानुसार AC
= 4r
अतः 4r
= √2 . a
a = 4r / √2
a = 2√2 r
r = a/2√2
unit cell का आयतन a3 होता है
अतः
आयतन
= (2√2 r)3
solve करने पर
unit cell का आयतन = 16√2 r3
FCC संरचना
unit cell 4 परमाणुओं
की बनी होती है
अतः चार गोलाकार परमाणुओं का
आयतन
एक
परमाणु का आयतन = (4/3) π
r3
4 परमाणु
का आयतन = 4 x (4/3) π
r3
संकुलन
दक्षता = (चार परमाणुओं का आयतन / unit
cell का आयतन ) x 100
चार परमाणुओं का आयतन तथा यूनिट
सेल के आयतन का मान सूत्र में रखने पर
FCC या CCP के लिए संकुलन दक्षता =
74%
BCC संरचना की संकुलन दक्षता ज्ञात करना
BCC
संरचना:
इस संरचना की unit
cell में घन के
आठों कोनों पर आठ परमाणु स्थित होते है तथा घन के केंद्र में एक परमाणु स्थित होता
है।
यह unit cell दो परमाणुओं की बनी होती हैं।
कुल परमाणुओं की संख्या = 8 x
1/8 + 1×1 = 2
अतः
ΔABC से
(AC)2 = (AB)2 + (BC)2
(AC)2 = a2 + a2
(AC)2 = 2 a2
ΔACD से
(AD)2 = (AC)2
+ (CD)2
(AD)2 = 2a2 +
a2
(AD)2 = 3 a2
(AD) = √(3 a2)
(AD) = √3
. a
चित्रानुसार
AD = 4r
अतः 4r
= √3 . a
a = 4r / √3
यूनिट
सेल का आयतन a3 होता है।
अतः
यूनिट
सेल का आयतन = (4r / √3)3
आयतन = (64r3 )/3√3
चूँकि यूनिट सेल दो परमाणुओं की
बनी होती हैं।
एक
परमाणु का आयतन = ( (4/3) π
r3
अतः
दो गोलाकार परमाणुओं का आयतन = 2 x (4/3) π r3
आयतन
= (8 /3)π r3
संकुलन
दक्षता = (दो परमाणुओं का आयतन /unit
cell का आयतन ) x 100
दो परमाणुओं का आयतन तथा यूनिट
सेल के आयतन का मान सूत्र में रखने पर
BCC संरचना की संकुलन दक्षता = 68%
सरल घनीय या आद्य मात्रक कोष्ठिक के लिए संकुलन
दक्षता
इस unit
cell में घन के
आठों कोनों पर आठ परमाणु होते है। यह यूनिट सेल एक परमाणु की बनी
होती है।
एक सरल घनीय जालक में केवल घन के
कोनों पर परमाणु उपस्थित होते हैं।
मान
लिया कि घन के एक भुजा की लम्बाई =a=a तथा प्रत्येक कण की त्रिज्या rr है।
चूँकि घन के किनारों पर कण एक
दूसरे के संपर्क में होते हैं,
अत: a=2ra=2r
घनीय
एकक कोष्ठिका का आयतन =a3=(2r)3=8r3=a3=(2r)3=8r3
चूँकि
सरल घनीय एकक कोष्ठिका में केवल 1 परमाणु होता है। अत: परमाणु
द्वारा भरे हुए स्थान का आयतन =43prr3=43prr3
अत: संकुलन क्षमता
=4/3πr38r3×100=4/3πr38r3×100
=π6×100=π6×100
=52.36%=52.4%=52.36%=52.4%
अत:
(a) hcp और ccp संरचनाओं में संकुलन
क्षमता (packing efficiency) = 74%
(b) अंत: केन्द्रित घनीय
(bcc) संरचनाओं में संकुलन क्षमता (packing efficiency) = 68%
(c) तथा सरल घनीय जालक (simple
cubic lattice) में
संकुलन क्षमता (packing efficiency) = 52.4%
अर्थात hcp और ccp संरचनाओं में संकुलन
क्षमता (packing efficiency) अधिकतम होती है।
एकक कोष्ठिका विमा संबंधी गणनाएं :
Unit
cell के
dimension की सहायता से यूनिट सेल का आयतन निकाला जा सकता है।
मान लिया कि Cubic
crystal (घनीय
क्रिस्टल) के Unit cell (एकक कोष्ठिका) के
कोर की लम्बाई =a=a
पदार्थ का घनत्व (Density) =d=d (पदार्थ तथा एकक
कोष्ठिका का घनत्व बराबर होता है।)
तथा मोलर द्र्वयमान (Molar Mass) =M=M है।
अत: Cubic
Crystal (घनीय
क्रिस्टल) के
Unit cell (एकक कोष्ठिका) का
आयतन =a3=a3
Unit
cell (एकक
कोष्ठिका) का द्र्व्यमान = एकक कोष्ठिका में परमाणु की संख्यां × एक परमाणु का
द्रव्यमान
=z⋅m=z⋅m
(जहाँ z=z= एकक कोष्ठिका में
उपस्थित परमाणुओं की संख्या
तथा m=m= एक परमाणु का द्रव्यमान)
एकक कोष्ठिका में
उपस्थित एक परमाणु का द्रव्यमान
m=MNAm=MNA
(जहाँ M=M= मोलर द्र्व्यमान तथा NA=NA= एवोगाड्रो संख्या
है।)
अत: एकक कोष्ठिका का घनत्व, dd
⇒d=z⋅ma3⇒d=z⋅ma3
⇒d=z⋅Ma3⋅NA⇒d=z⋅Ma3⋅NA
⇒d=zMd3NA⇒d=zMd3NA
अत: उपरोक्त सूत्र के पाँच पैरामीटरों, d,
z, M, a तथा
NA, में
से किसी चार के ज्ञात रहने पर पाँचवें की गणना उपरोक्त सूत्र से, की जा सकती है।
FCC संरचना के लिए यूनिट सेल के किनारो की लम्बाई व परमाणु त्रिज्या के
मध्य सम्बन्ध:
r = a/2√2
BCC संरचना के लिए यूनिट सेल के किनारों (कोर) की लम्बाई व परमाणु
त्रिज्या के मध्य सम्बन्ध:
r = √3 . a/4
ठोसों में अपूर्णताएं या ठोस पदार्थो में दोष त्रुटि | परिभाषा | प्रकार
आदर्श ठोस किसे कहते है:
परम शून्य ताप पर अर्थात 0
(k) केल्विन
ताप पर ठोस के अवयवी कण नियमित क्रम में व्यवस्थित रहते है इन्हे आदर्श ठोस कहते
है।
सामान्य ताप पर ठोस के अवयवी कण
नियमित क्रम में नहीं रहते अर्थात ठोस में अपूर्णताऐं या दोष होते है।
ये दो प्रकार के होते
है :
1. बिंदु दोष
2. रेखीय दोष
(1) बिंदु दोष :
जालक बिंदु के चारों ओर परमाणुओं
की आदर्श व्यवस्था में विचलन से उत्पन्न दोष को बिंदु दोष कहते है।
(2) रेखीय दोष :
जालक बिंदु को मिलाने वाली
पंक्तियों की आदर्श व्यवस्था में विचलन से उत्पन्न दोष को रेखीय दोष कहते हैं।
बिंदु दोष :
बिंदु दोष तीन प्रकार के होते
है।
(a) स्ट्राइकियोमिट्री
दोष
(b) नॉन स्ट्राइकियोमिट्री
दोष
(c) अशुद्धता दोष
आइये बिंदु दोष के इन तीनो
प्रकार के दोषो के बारे में विस्तार से पढ़ते है।
(a) स्ट्राइकियोमिट्री
दोष : इन दोषों में यौगिक की स्ट्राइकियोमिट्री बनी रहती है।
ये दोष चार प्रकार के होते है।
(१) रिक्तिका दोष :
इस दोष में कुछ स्थानों पर अवयवी
कण अपने स्थान से हट जाते है तथा उनके स्थान पर रिक्तिकाएँ बन जाती है।
इस दोष के कारण घनत्व में कमी आ
जाती है।
(२) अन्तराकाशीय दोष :
इस दोष में कुछ अवयवी कण
अन्तराकाशी स्थान में आ जाते है।
इस दोष के कारण घनत्व में वृद्धि
हो जाती है।
नोट : उपरोक्त दोनों दोष नोन
आयनिक यौगिकों में पाये जाते है , ये ताप के प्रभाव से उत्पन्न
होते है अतः इन्हे ऊष्मा गतिकी दोष भी कहते है।
नोट : आयनिक यौगिकों में निम्न
दोष पाए जाते है|
(३) शॉटकी दोष :
इस दोष में जितने धनायन अपने
स्थान से हटते है उतने ही ऋणायन भी अपने स्थान से हट जाते हैं।
इस दोष के कारण घनत्व में कमी हो
जाती है।
वे आयनिक यौगिक जिनमे धनायन
ऋणायन के आकार लगभग समान होता है उनमे यह दोष होता है।
इसे रिक्तिका दोष
भी
कहते हैं।
उदाहरण : NaCl
, CsCl , AgBr आदि।
(४) फ्रैंकल दोष :
इस दोष में धनायान अपने स्थान से
हटकर अंतराकाशी स्थान में चला जाता है।
इस दोष के कारण दोष के घनत्व में
परिवर्तन नहीं होता।
वे आयनिक यौगिक जिनमे धनायन व
ऋणायन के आकार में अधिक अंतर होता है उनमे यह दोष पाया जाता है।
इस दोष के कारण परावैधुतांक कम
हो जाता है।
उदाहरण : AgCl
, AgBr , AgI , ZnS आदि।
नोट : AgBr
में
शॉटकी व फ्रैंकल दोनों दोष पाए जाते हैं।
(b) नॉन
स्ट्राइकियोमिट्री दोष :
वे त्रुटि युक्त क्रिस्टल
संरचनायें जिनमे धनायन व ऋणायन की संख्याओं का अनुपात यौगिक के रासायनिक सूत्र के
अनुरूप नहीं होता , उनमे
नॉन स्ट्राइकियोमिट्री दोष होते हैं।
उदाहरण : FeO
में
Fe व O का
अनुपात 1:1 न होकर 0.93 से 0.96 : 1 होता है।
ये दोष दो प्रकार के होते है।
(१) धातु आधिक्य दोष :
यह दो प्रकार का होता हैं।
(अ) ऋणायन के अभाव से :
इस दोष के कारण ऋणायन अपने स्थान
से हट जाते है तथा उस स्थान पर इलेक्ट्रॉन आ जाते है।
जिस
स्थान पर इलेक्ट्रॉन रहते है उसे F केंद्र कहते है।
अर्थात
रंग उत्पन्न करने वाला केंद्र , इस दोष के कारण NaCl
हल्का
पीला , KCl बैंगनी होता हैं।
नोट
: जब नमक को सोडियम वाष्प के संपर्क में लाया जाता है तो उसकी सतह पर सोडियम
परमाणु आ जाते है जबकि NaCl में से क्लोराइड आयन हटकर सोडियम के संपर्क में आ जाता है।
सोडियम
अपना इलेक्ट्रॉन त्यागकर Na+ आयन बना लेता है।
यह
इलेक्ट्रॉन उस स्थान पर आ जाता है जहाँ से क्लोराइड आयन हटता है।
(ब) अतिरिक्त धनायन के कारण :
अतिरिक्त
धनायन के अंतराकाशी स्थान में जाने से ZnO सफ़ेद रंग का होता है।
जब
इसे गर्म करते है तो कुछ Zn2+ आयन अंतराकाशी स्थान
में आ जाते है। ठोस की विधुत उदासीनता को बनाये रखने के लिए कुछ इलेक्ट्रॉन भी
अंतराकाशी स्थान में आ जाते है जिससे ZnO का रंग पीला हो जाता
है।
(२) धातु न्यूनता दोष :
इस दोष में कुछ धनायन अपने स्थान
से हट जाते है। ठोस की विधुत उदासीनता को बनाये रखने के लिए अन्य धातु आयन अपनी
ऑक्सीकरण अवस्था को बढ़ा देते है।
नोट : संक्रमण तत्वों के यौगिकों
में यह दोष पाया जाता है।
(c) अशुद्धता दोष :
जब
NaCl में SrCl2 की अशुद्धि मिली होती
है तो कुछ Na+ आयन के स्थान पर Sr+ आयन आ जाते है।
ठोस
की विधुत उदासीनता को बनाये रखने के लिए उतने ही Na+ आयन हट जाते है।
ठोसों के विधुतीय गुण
ठोसों में विधुतीय गुण,
इलेक्ट्रॉनों
या धन छिद्रों की गति के द्वारा अथवा आयनों की गति के द्वारा होता है। धन छिद्रों
या इलेक्ट्रॉनों की गति को इलेक्ट्रॉनिक चालकता (Electrical conductivity) तथा आयनों की गति को आयनिक चालकता
(Ionec
conductivity) कहते है।
आयनों अथवा घनात्मक छिद्रो में चालकता इलेक्ट्रॉनिक दोश के कारण होती है।
इलेक्ट्रॉनों से चालन को n-
चालन तथा
धन छिद्रों में से चालन को P चालन कहतें है।
शुद्ध आयनिक ठोस जहाँ चालन केवल आयनों की गति द्वारा होता है विघुत् उदासीन
होते है,
इनमें से
गलित या विलयन अवस्था में ही विघुत् प्रवाहित हो सकती है। विघुत् चालकता के आधार
पर ठोस तीन प्रकार के होते हैं-
- सुचालक (Conductor) – इनमें विघुत्धारा का अधिकतम प्रवाह हो सकता
है। इनकी चालकता 108 ओम.1 सेमी.1 कोटि की होती है। उदाहरण- धातुएँ (जैसे- Al,Cu,Ag) विघुत्-अपघट्य, (जैसे- NaCl, H2SO4)
- कुचालक (Non-Conductor)
– इनमें
प्रायोगिक रूप से विघुत् का प्रवाह नहीं होता है तथा इनकी विघुत चालकता 10-23 ओम.1 सेमी.1 कोटि की होती है। उदाहरण- अधातु में (जैसे-P,S) विघुत् अन अपघट्य (जैसे- यूरिया, सुक्रोज)
- अर्द्धचालक (Semiconductor)
– सामान्य ताप पर किसी
अर्द्धचालक की विघुत् चालकता, सुचालक
व कुचालक के मध्य (10-9 से 102 ओम
10.1 सेमी-1 कोटि)
की होती है। पूरमशून्य ताप पर ये पूर्ण कुचालक होते है, परन्तु कमरे के ताप पर कुछ विघुत् धारा
प्रवाहित कर सकते है। उदाहरण- Si, Ge आदि।
1.
अर्द्धचालकों की चालकता उनमें उपस्थित अशुद्धियों अथवा क्रिस्टल जालक में दोश
के कारण होता है।
2.
ताप में वृद्धि से इनकी चालकता बढ़ती है, जबकि धातुओं की चालकता घटती है।
3.
अर्द्धचालकों के गुण,
अशुद्धि की
प्रकृति के आधार पर परिवर्तित होते है। अर्द्धचाजलक, ट्राँजिस्टरों में तथा प्रसारणीय मानकों में
प्रकाश विघुत्ीय यंत्रो (Photoelectric
devices) के रूप में
प्रयुक्त होते है।
चालक , कुचालक तथा
अर्धचालक की बैंड सिद्धांत व्याख्या
Table of Contents
·
बैंड
सिद्धांत किसे कहते है – Band Siddhant Kya Hai:
o
डोपिंग किसे कहते है –
Doping Kise Kahate Hain:
बैंड सिद्धांत किसे कहते है –
Band Siddhant Kya Hai:
इस सिद्धान्त के अनुसार जितने परमाणु कक्षक आपस में मिलते है उतने ही अणु
कक्षकों का निर्माण होता है। जब बहुत सारे परमाणु कक्षक आपस में मिलते है तो उतने ही अधिक संख्या में अणु
कक्षको का निर्माण होता है।
इस अणु कक्षको की ऊर्जाओं में अंतर बहुत कम होता है। ये परस्पर मिलकर एक बैंड
का निर्माण कर लेते है।
अतः इसे
बैंड सिद्धांत कहते हैं।
इस सिद्धान्त द्वारा चालक , कुचालक व अर्द्धचालक
की व्याख्या निम्न प्रकार से की जा सकती है।
● चालक अथवा सुचालक ( Conductor )
● कुचालक अथवा अचालक ( Insulator )
● अर्द्धचालक ( Semiconductor )
चालक अथवा सुचालक:
वे पदार्थ जिनमें विद्युत धारा का प्रवाह आसानी से हो जाता
है, चालक पदार्थ कहलाते है । चालको मे
मुक्त इलेक्ट्राॅन की संख्या अधिक होती है ।
उदाहरण – चांदी, तांबा, एल्युमीनियम आदि ।
उपयोग – विद्युत धारा के प्रवाहन एवं
विद्युत चलित उपकरणों के निर्माण में
अच्छे सुचालक के गुण –
● चालक का प्रतिरोध बहुत कम होना
चाहिए ।
● चालक सस्ता तथा सरलता से उपलब्ध होना चाहिए ।
● चालक मजबूत होना चाहिए ।
कुचालक अथवा अचालक:
वे पदार्थ जिनमें विद्युत धारा प्रवाहित नहीं होती है, अचालक पदार्थ कहलाते हैं तथा
इनमें मुक्त इलेक्ट्राॅन नहीं (न के बराबर)
होते है ।
उदाहरण – रबर, प्लास्टिक, कांच आदि ।
उपयोग – चालक तारों के आवरण के लिए, विद्युतरोधी वस्तुओं के निर्माण
में ।
कुचालक के गुण –
● प्रतिरोध उच्च होना चाहिए ।
● सस्ता एवं सरलता से उपलब्ध होना चाहिए ।
● कुचालक पदार्थ मजबूत और जलरोधी होना चाहिए ।
अर्द्धचालक:
वे पदार्थ जिनमें सामान्य परिस्थितियों मे विद्युत धारा
प्रवाहित नहीं होती परन्तु तापमान बढ़ाने या अशुद्धि मिलाने पर इनकी चालकता बढ़
जाती है और इनमे से धारा प्रवाहित होने लगती है, ऐसे पदार्थ अर्द्धचालक कहलाते हैं ।
इनका प्रतिरोध चालक पदार्थ से अधिक लेकिन अचालक पदार्थ से
कम होता है, इनमें कम मात्रा में मुक्त इलेक्ट्राॅन पाये जाते है ।
उदाहरण – सिलिकॉन तथा जर्मेनियम
उपयोग – इलेक्ट्रॉनिक युक्ति जैसे डायोड, ट्रांजिस्टर, LED आदि के निर्माण में ।
डोपिंग किसे कहते है – Doping Kise Kahate Hain:
अर्धचालकों
में उसकी चालक क्षमता को कम या ज्यादा करने के लिए उसमें किसी दूसरी धातुओं को
मिलाया जाता है और इसी दूसरी धातुओं को मिलाने की पूरी प्रक्रिया को डोपिंग कहते हैं |
किसी भी मटेरियल में दूसरा
मटेरियल बनाने के लिए सबसे पहले उसकी एटॉमिक प्रॉपर्टी को देखा जाता है कि वह
दोनों मटेरियल आपस में Doped हो सकते हैं या नहीं. अर्धचालक की Doping प्रक्रिया में में जो
पदार्थ मिलाया जाता है उसे N-Type कहते हैं और वह
पदार्थ जिस पदार्थ के अंदर मिलाया जाता है P-Type अर्धचालक कहते हैं.
ठोसों में चुंबकीय गुण | अनुचुम्बकत्व | प्रति चुंबकत्व | लौह चुंबकत्व
Table of Contents
·
ठोसों में चुंबकीय गुण –
thoso me chumbakiya gun:
o
§ अनुचुंबकत्व (paramagnetism)
किसे कहते
है:
§ 2.
प्रति
चुंबकत्व (diamagnetism) किसे कहते
है:
§ 3. लौह चुंबकत्व (ferromagnetism)
किसे कहते
है:
ठोसों में चुंबकीय गुण –
thoso me chumbakiya gun:
इलेक्ट्रॉन नाभिक के चारों ओर दो प्रकार से गति करता है।
(1) कक्षीय गति
(2) चक्रीय गति
जब भी कोई ऋणावेशित कण नाभिक के
चारों ओर चक्कर लगाता है तो उसके चारो ओर एक चुंबकीय क्षेत्र का निर्माण हो जाता
है जिससे इलेक्ट्रॉन नन्हे (छोटे) चुम्बक की भाँति व्यवहार करता है।
चुंबकीय
गुणों को चुंबकीय आघूर्ण से व्यक्त करते है। ठोस पदार्थों को
बाह्य चुम्बकीय क्षेत्र में रखने पर वे निम्न प्रकार व्यवहार दर्शाते है।
1. अनुचुंबकत्व (paramagnetism) किसे कहते
है:
अनुचुम्बकत्व (Paramagnetism)
पदार्थों
का वह गुण है जिसमें पदार्थ बाहर से आरोपित चुम्बकीय क्षेत्र की दिशा में ही
चुम्बकीय क्षेत्र पैदा करते हैं। ये पदार्थ वाह्य चुम्बकीय क्षेत्र द्वारा आकर्षित
किये जाते हैम। इनका व्यवहार प्रतिचुम्बकीय पदार्थों के चुम्बकीय व्यवहार के ठीक
उल्टा होता है। अधिकांश रासायनिक तत्त्व और कुछ रासायनिक यौगिक अनुचुम्बकीय पदार्थ
हैं।
- ये बाह्य चुंबकीय
क्षेत्र द्वारा दुर्बलता से आकर्षित होते है।
- इनमे अयुग्मित
इलेक्ट्रॉन होते है।
- चुंबकीय आघूर्ण का
मान निश्चित होता है।
- उदाहरण : Fe2+ , Cr3+ , Ni2+ , O2 आदि।
2. प्रति चुंबकत्व (diamagnetism)
किसे कहते है:
प्रतिचुम्बकीय पदार्थ वे हैं
जिनमें बाहर से आरोपित चुम्बकीय क्षेत्र के उल्टी दिशा में चुम्बकीय क्षेत्र
प्रेरित होता है। ये पदार्थ वाह्य चुम्बकीय क्षेत्र द्वारा प्रतिकर्षित (रिपेल)
किये जाते हैं। अर्थात इनका व्यवहार अनुचुम्बकीय पदार्थों के चुम्बकीय व्यवहार के
उल्टा होता है। प्रतिचुम्बकत्व एक क्वाण्टम यांत्रिक प्रभाव है और सभी पदार्थ यह
गुण प्रदर्शित करते हैं।जब अन्य चुम्बकीय प्रभाव नगण्य हों तो ऐसे पदार्थों को
प्रतिचुम्बकीय कह दिया जाता है।
- ये बाह्य चुंबकीय
क्षेत्र द्वारा प्रतिकर्षित होते है।
- इनमे सभी इलेक्ट्रॉन
युग्मित होते है।
- इनका चुंबकीय आघूर्ण
शून्य होता है क्योंकि एक इलेक्ट्रॉन का चुंबकीय आघूर्ण दूसरे इलेक्ट्रॉन के
चुंबकीय आघूर्ण को नष्ट कर देता है। (चक्रण की दिशा विपरीत होने के कारण )
- उदाहरण : NaCl
, C6H6 , H2O आदि।
3. लौह चुंबकत्व (ferromagnetism) किसे कहते है:
लौहचुंबकत्व (Ferromagnetism)
(फेरीचुंबकत्व
को मिलाकर) ही वह मूलभूत तरीका है जिससे कुछ पदार्थ (जैसे लोहा) स्थायी चुम्बक
बनाते हैं या दूसरे चुम्बकों की ओर आकृष्ट होते हैं। वैसे प्रतिचुम्बकीय
(डायामैग्नेटिक) और अनुचुम्बकीय (पैरामैग्नेटिक) पदार्थ भी चुम्बकीय क्षेत्र में
आकर्षित या प्रतिकर्षित होते हैं |
किन्तु इन पर लगने वाला बल इतना
कम होता है कि उसे प्रयोगशालाओं के अत्यन्त सुग्राही (सेंस्टिव) उपकरणों द्वारा ही
पता लगाया जा सकता है। प्रतिचुम्बकीय और अनुचुम्बकीय पदार्थ स्थायी चुम्बकत्व नहीं
दे सकते। कुछ ही पदार्थ लौहचुम्बकत्व का गुण प्रदर्शित करते हैं जिनमें से मुख्य
हैं – लोहा, निकल, कोबाल्ट तथा इनकी
मिश्रधातुएँ, कुछ
रेअर-अर्थ धातुएँ, तथा
कुछ सहज रूप में प्राप्त खनिज आदि।
- वे पदार्थ जो बाह्य
चुंबकीय क्षेत्र द्वारा प्रबलता से आकर्षित होते है तथा चुंबकीय क्षेत्र हटा
लेने के पश्चात स्वयं चुम्बक की भांति व्यवहार करते है उन्हें लौह चुम्बक
पदार्थ कहते है।
- लौह चुम्बकीय
पदार्थो में धातु आयन छोटे छोटे खंडो में समूहित रहते है जिन्हे डोमेन कहते
है। बाह्य चुंबकीय क्षेत्र की अनुपस्थिति में ये डोमेन अव्यवस्थित रहते है
परन्तु चुंबकीय क्षेत्र की उपस्थिति में सभी डोमेन व्यवस्थित हो जाते है। चुंबकीय
क्षेत्र हटा लेने के पश्चात भी यह व्यवस्था बनी रहती है जिससे लौह चुंबकीय
पदार्थो से स्थायी चुंबके बनायीं जाती है।
- उदाहरण : Fe , CO , Ni , CrO2 आदि
विलयन नोट्स
दो या दो से अधिक पदार्थो के समांगी मिश्रण को विलयन कहते है।
विलयन (समांगी मिश्रण) के प्रत्येक भाग का संघटन समान होता है।
समांगी मिश्रण:- वह मिश्रण जिसमें दो या दो से अधिक अवयव पूर्ण रूप से घुलनशील होते है। समांगी मिश्रण कहते है।
जैसे- जल में नमक, जल में चीनी आदि।
विषमांगीे मिश्रण:- वह मिश्रण जिसमें अवयव घुलनशील नही होते है। इन अवयवो को आसानी से अलग-अलग देखा जा सकता है। विषमांगीे मिश्रण कहते है।
जैसे- जल और तेल, जल में मिट्टी, पानी में चाॅक आदि।
विलेय तथा विलायक:- विलयन में उपस्थित जो घटक अधिक मात्रा में होता है उसे विलायक तथा जो घटक कम मात्रा में उपस्थित होता है उसे विलेय कहते है।
जैसे- जल में चीनी का मिश्रण
जल में चीनी का मिश्रण तभी प्राप्त होगा जब जल की मात्रा अधिक तथा चीनी की मात्रा कम होगी इसलिए जल विलायक है तथा चीनी विलेय है।
या
दूसरे शब्दो में आप कह सकते है अवयव को जिसमें घोला जाता है उसे विलायक कहते है तथा अवयव जिसको घोला जाता है उसे विलेय कहते है। विलायक की मात्रा सदैव विलेय से अधिक होती है।
तथा
विलयन = विलेय + विलायक
विलयनो के प्रकार:-
विलयनो को निम्नलिखित दो भागो में विभाजित किया जा सकता है-
- अवयवो की मात्रा के आधार पर -
तनु और सान्द्र विलयन:- वह विलयन जिसके एकांक आयतन में विलेय की सान्द्रता कम होती है तनु विलयन कहते है। तथा
वह विलयन जिसके एकांक आयतन में विलेय की सान्द्रता अधिक होती है सान्द्र विलयन कहते है।
अर्थात्
विलयन में विलेय की अधिक मात्रा सान्द्र और कम मात्रा तनु विलयन कहलाती है।
संतृप्त और असंतृप्त विलयन:- स्थिर ताप पर वह विलयन जिसमें विलेय की अधिकतम सम्भव मात्रा घुली हो संतृप्त विलयन कहलाता है।
वह विलयन जिसमें विलेय की मात्रा संतृप्त विलयन के लिए आवश्यक मात्रा से कम होती है असंतृप्त विलयन कहलाता है।
अतिसंतृप्त विलयन:- स्थिर ताप पर जब किसी विलयन में विलेय की मात्रा संतृप्त विलयन से अधिक हो जाती है तो उस विलयन को अतिसंतृप्त विलयन कहते है।
- विलायको की भौतिक अवस्था के आधार पर-
गैसीय विलयन:- वह विलयन जिसमें विलायक गैसीय अवस्था में होता है। गैसीय विलयन कहते है।
गैसीय विलयन = विलेय + (विलायक)गैस
द्रव विलयन:- वह विलयन जिसमें विलायक द्रव अवस्था में होता है जबकि विलेय पदार्थ ठोस, द्रव, अथवा गैस अवस्था में हो सकता है।
द्रव विलयन = (विलेय)ठोस, द्रव अथवा गैस + (विलायक)द्रव
ठोस विलयन:- वह विलयन जिसमें विलायक ठोस अवस्था में होता है। ठोस विलयन कहलाता है।
ठोस विलयन = विलेय + (विलायक)ठोस
विलेयता -
किसी पदार्थ की वह अधिकतम मात्रा जो निश्चित ताप पर 100 g विलायक में घुल जाती है उस पदार्थ की विलेयता कहलाती है।
विलयन की सान्द्रता -
विलयन के प्रति इकाई आयतन में उपस्थित विलेय की मात्रा विलयन की सान्द्रता कहलाती है।
विलयन की सान्द्रता को प्रदर्शित करने की प्रमुख विधियां -
- द्रव्यमान प्रतिशत (w/w):- 100 g विलयन में उपस्थित (ग्रामो में) विलेय की मात्रा को द्रव्यमान प्रतिशत कहते है। इसे भार प्रतिशत (w/w) भी कहा जाता है।
 | |
| Mass-Percentage-Formula |
- आयतन प्रतिशत (v/v):- 100 ml विलयन में उपस्थित (ml में) विलेय की मात्रा को आयतन प्रतिशत कहते है।
 | |
| Volume-Percentage-Formula |
- ग्राम प्रति लीटर या द्रव्यमान / आयतन प्रतिशत (w/v):- विलेय पदार्थ की ग्राम में वह मात्रा जो 100 ml विलयन में घुली हो द्रव्यमान / आयतन प्रतिशत कहलाती है।
- अंश प्रति मिलियन (PPM):- किसी विलयन के एक मिलियन (दस लाख) ग्राम में उपस्थित विलेय की (ग्राम में) मात्रा को अंश या पार्ट्स प्रति मिलियन (PPM) में सान्द्रता कहते है।
 |
| Parts-Per-Million-Formula |
- मोललता (m):- विलायक के 1000 ग्राम (1 kg) में घुलित विलेय के मोलो की संख्या को विलयन की मोललता कहते है। इसे m से प्रदर्शित करते है।
 |
| Molality-Formula |
- मोलरता (M):- एक लीटर (1 L) विलयन में घुले विलेय के मोलो की संख्या को उस विलयन की मोलरता कहते है। इसे M से प्रदर्शित करते है।
 |
| Molarity-Formula |
- नाॅर्मलता:- किसी निश्चित ताप पर विलयन के एक लीटर (1 L) में घुलित विलेय के ग्राम तुल्यांको की संख्या को उस ताप पर विलयन की नाॅर्मलता कहते है।
 |
| Normality-Formula |
- मोल प्रभाज:- विलयन में किसी घटक विशेष का मोल प्रभाज उस घटक के मोलो की संख्या तथा विलयन में उपस्थित सभी घटको के कुल मोलो की संख्या के अनुपात के बराबर होता है।
 |
| Mole-Fraction-Formula |
यदि किसी विलयन में घटक A के मोल nA तथा घटक B के nB मोल उपस्थित है, तो A तथा B के मोल प्रभाज मे मान निम्न होंगें।
A के मोल प्रभाज = nA / nA + nB
B के मोल प्रभाज = nB / nA + nB
हेनरी का नियम -
इस नियम के अनुसार-
स्थिर ताप पर किसी गैस की द्रव में विलेयता, गैस के दाब के समानुपाती होती है।
हेनरी के नियम के लिए विलेय गैस तथा विलायक द्रव होती है।
अर्थात् - m ∝ P
m = KH P यहां KH - हेनरी स्थिरांक है
P = m / KH
हेनरी के नियम की सीमाएं-
- हेनरी का नियम बहुत निम्न ताप पर लागू नहीं होता है।
- दाब का मान बहुत अधिक होने पर भी यह नियम कार्य नहीं करता है।
- यह नियम तभी लागू होता है जब गैस की विलेयता का मान विलायक में बहुत कम होता है।
- यह नियम ऐसे विलयनो पर लागू नहीं होता है जिसमें विलेय विलायक से रासायनिक अभिक्रिया करता है।
वाष्पदाब (Vapour Pressure)-
द्रव और उसकी वाष्प के मध्य साम्यावस्था में स्थिर ताप पर लगने वाला वाष्प का दाब ' वाष्पदाब ' कहलाता है।
वाष्पदाब में अवनमन-
जब किसी विलायक में कोई अवाष्पशील पदार्थ घोला जाता है तो विलयन का वाष्पदाब कम हो जाता है। इस घटना को वाष्पदाब में अवनमन कहते है।
वाष्पदाब में अवनमन = विलयन के वाष्पदाब का अवनमन / विलायक का वाष्पदाब
= Po – Ps / Po
यहां - Po – Ps ⇾ विलयन के वाष्पदाब का अवनमन
Po ⇾ विलायक का वाष्पदाब
राउल्ट का नियम -
दिए गए ताप पर द्रव विलयन के किसी घटक का आंशिक वाष्पदाब उसके मोल प्रभाज के समानुपाती होता है।
यदि विलयन में विलेय के अणुओ की संख्या n और विलायक के अणुओ की संख्या N है। तो विलेय का मोल प्रभाज n / n+N होगा।
राउल्ट के नियम के अनुसार-
Po – Ps / Po = n / n+N
जहां - Po विलायक का वाष्पदाब
Ps विलयन का वाष्पदाब
Po – Ps वाष्पदाब का अवनमन
राउल्ट के नियम की सीमाएं-
- यह नियम केवल तनु विलयनो पर लागू होता है।
- यह नियम उन तनु विलयनो पर लागू होता है जिनमें अवाश्पशील विलेय घुले हो।
- यह नियम उन विलयनो पर लागू नहीं होता है जो विलयन में वियोजित या संगुणित होते है।
आदर्श तथा अनादर्श विलयन-
आदर्श विलयन:- वे विलयन जो सभी तापो पर तथा सान्द्रताओ पर राउल्ट के नियम का पूर्णतया पालन करते है। आदर्श विलयन कहलाते है।
PA = PAo xA
PB = PBo xB
कुल दाब P = PA + PB
यहां xA - A का मोल प्रभाज
xB - B का मोल प्रभाज
PA - द्रव A का विलयन में वाष्पदाब
PB - द्रव B का विलयन में वाष्पदाब
PAo - शुद्ध द्रव A का वाष्पदाब
PBo - शुद्ध द्रव B का वाष्पदाब
अनादर्श विलयन:- वे विलयन जो राउल्ट के नियम का पालन नहीं करते है। अनादर्श विलयन कहलाते है।
PA ≠ PAo xA
PB ≠ PBo xB
कुल दाब P ≠ PA + PB
अणुसंख्य गुणधर्म-
विलयनो के वे गुण जो विलायक की एक निश्चित मात्रा में उपस्थित विलेय कणो (अणु अथवा आयन ) की संख्या पर निर्भर करते है किन्तु विलेय की रासायनिक प्रकृति पर निर्भर नहीं करते है। अणुसंख्य गुणधर्म कहलाते है।
विलयनो के महत्वपूर्ण अणुसंख्य गुणधर्म-
- वाष्पदाब में आपेक्षिक अवनमन
- क्वथनांक में उन्नयन
- हिमांक में अवनमन
- परासरण दाब
- वाष्पदाब में आपेक्षिक अवनमन:- विलायक के वाष्पदाब में अवनमन तथा शुद्ध विलायक के वाष्पदाब के अनुपात को वाष्पदाब में आपेक्षिक अवनमन कहते है।
तथा राउल्ट के नियमानुसार अवाष्पशील विलेय पदार्थो के विलयन के लिए वाष्पदाब में आपेक्षिक अवनमन विलयन में विलेय के मोल प्रभाज के बराबर होता है।
Po – Ps / Po = विलेय के मोल प्रभाज
- क्वथनांक में उन्नयन (△Tb):- किसी अवाष्पशील विलेय पदार्थ को किसी विलायक में घोलने पर विलायक के क्वथनांक में वृद्धि होती है जिसे क्वथनांक में उन्नयन कहा जाता है।
△Tb ∝ m
△Tb = Kb m
यहां - m- मोललता
Kb- मोलल उन्नयन स्थिरांक
- हिमांक में अवनमन:- जब किसी विलेय पदार्थ को विलायक में घोला जाता है तो विलायक का हिमांक कम हो जाता है। हिमांक में उत्पन्न इस कमी को हिमांक में अवनमन कहते है।
- परासरण दाब:- किसी विलयन तथा विलायक को अर्द्धपारगम्य झिल्ली द्वारा पृथक करके उसके परासरण को रोकने के लिए विलयन पर कम-से-कम जितना बाह्य दाब लगाना पड़ता है। उसे विलयन का परासरण दाब कहते है।
वाण्ट-हाॅफ कारक / गुणांक (i)-
किसी अणुसंख्य गुणधर्म के प्रायोगिक मान तथा सामान्य मान के अनुपात को वाण्ट-हाॅफ कारक या गुणांक कहते है। इसे i से प्रदर्शित करते है।
 |
| Van't-Hoff-Formula |
परीक्षा से संबंधित अन्य महत्वपूर्ण प्रश्न -
प्रश्न :- समपरासारी, अल्पपरासारी तथा अतिपरासारी विलयन क्या होते है ?
समपरासारी विलयन:- वे विलयन जिनके परासरण दाब समान होते है, समपरासारी विलयन कहलाते है। समपरासारी विलयनों की मोलर सान्द्रताएं समान होती है।
अल्पपरासारी विलयन:- दो विलयनों में, जिस विलयन का परासरण दाब कम होता है, उसे अल्पपरासारी विलयन कहते है।
अतिपरासारी विलयन:- दो विलयनों में, जिस विलयन का परासरण दाब अधिक होता है, उसे अतिपरासारी विलयन कहते है।
प्रश्न :- छिला हुआ अण्डा जल में रखने पर फूलता है परन्तु सान्द्र नमक के विलयन में सिकुड़ जाता है, क्यों ?
ऐसा परासरण के कारण होता है। विलायक का प्रवाह कम सान्द्रता से अधिक सान्द्रता के विलयन की ओर होता है। अतः जल (कम सान्द्रता) में अण्डा फूल जाता है क्योकि विलायक (जल) का प्रवाह अधिक सान्द्रता अर्थात् अण्डे के भीतर की ओर होता है जबकि सान्द्र नमक के विलयन में अण्डा सिकुड़ जाता है क्योकि इसमें विलयन का विपरीत दिशा में प्रवाह होता है।
प्रश्न :- परासरण दाब किसे कहते है ? बर्कले तथा हार्टले की विधि द्वारा विलयन के परासरण दाब का मापन कैसे किया जाता है ?
परासरण दाब :- ⬆️ उपर बताया गया है ⬆️
बर्कले-हार्टले विधि द्वारा परासरण दाब का मापन :- यह परासरण दाब निर्धारण की सबसे उत्तम विधि है। इस विधि में एक सरन्ध्र पात्र के छिद्रों में विद्युत विधि द्वारा काॅपर फेरोसायनाइड की पतली परत जमी हुई अर्द्धपारगम्य झिल्ली का प्रयोग करते है।
 | |
| Berkley-and-Hartley's-Method-Diagram |
सरन्ध्र पात्र में शुद्ध जल भरकर इसे एक बेलनाकार पात्र पर स्थिर करते है। बेलनाकार पात्र में वह विलयन भर लिया जाता है, जिसका परासरण दाब ज्ञात करना होता है। बेलनाकार पात्र में एक पिस्टन तथा दाबमापी यन्त्र लगा होता है। इस दाब को उपकरण में लगे दाबमापी यन्त्र से ज्ञात कर लेते है। इस प्रकार बर्कले-हार्टले विधि द्वारा परासरण दाब का मापन किया जाता है।
प्रश्न :- दो द्रव A तथा B क्रमशः 145 oC तथा 180 oC पर उबलते है। 80 oC पर इनमें से किसका वाष्प दाब उच्च होगा ?
क्वथनांक कम होने पर द्रव अधिक वाष्पशील होगा, अतः द्रव A का वाष्प दाब 80 oC पर अधिक होगा।
प्रश्न :- प्रतिहिम क्या है ?
वह पदार्थ जो जल में मिलाए जाने पर इसके हिमांक को कम कर देता है, प्रतिहिम कहलाता है।
जैसे- एथिलीन ग्लाइकाॅल।
प्रश्न :- द्रव अमोनिया की बोतलों को खोलने से पूर्व बर्फ से ठण्डा क्यों किया जाता है ?
साधारण ताप पर द्रव अमोनिया का वाष्प दाब उच्च होता है। ठण्डा करने पर वाष्प दाब घट जाता है, अतः द्रव अमोनिया बोतल से स्वयं बाहर नहीं निकलती है।
विलयन क्या है –
दो या दो से अधिक अवयवों के समांगी मिश्रण को विलयन कहा जाता है। जैसे नमक तथा जल का मिश्रण, ऑक्सीजन तथा नाइट्रोजन का मिश्रण, चीनी तथा जल का मिश्रण आदि।
वह विलयन दो घटको से मिलकर बना होता है , उसे द्विअंगीय विलयन कहते है।
जैसे:- नमक तथा जल का विलयन, सिरके तथा जल का विलयन, ऑक्सीजन तथा नाइट्रोजन का विलयन, आदि।
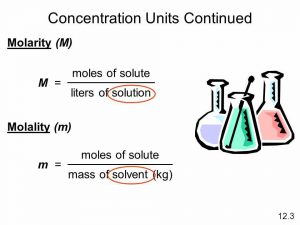
मोलरता की परिभाषा – molarta kya hai in hindi:
एक लीटर विलयन में किसी विलेय के मोलो की संख्या को मोलरता (Molarity) कहते है , इसे M से व्यक्त करते है।
मोलरता 
उदाहरण के लिए: NaOH के 0.25 mol L–1 (0.25 M) विलयन का अर्थ है कि NaOH के 0.25 मोल को 1 लीटर (एक क्यूबिक डेसीमीटर) विलयन में घोला गया है।
Note:
- मोलरता (Molarity) की इकाई (unit) मोल/लीटर (mol/L) होती है।
- मोलरता ताप(Heat) से प्रभावित होता है।
मोलरता के सवाल:
Ques: 4 ग्राम NaOH (कास्टिक सोडा)(Caustic soda) 1 लीटर जलीय विलयन में घुला हुआ है , मोलरता ज्ञात करो।
Ans: मोलरता (Molarata)(M) = विलेय का ग्राम में भार / अणुभार x विलयन का आयतन (लीटर में )
M = 4 / 40 x 1
= 1/10 M
= M / 10
Ques: 12.6 ग्राम C2H2O2.2H2O क्रिस्टलीय ऑक्सैलिक अम्ल(Crystalline oxalic acid) 500 ग्राम जलीय विलयन में उपस्थित है तो मोलरता ज्ञात करो।
Ans: M = 12.6 / 126 x 500/1000
M = 12.6/126 x 1/2
M = 2/10
= 0.2 M
मोललता क्या है परिभाषा | सूत्र | उदाहरण
Table of Contents
मोललता की परिभाषा – molalta kya hai:
एक किलोग्राम विलायक में किसी विलेय की मोलो की संख्या को मोललता कहते है। इसे m (small m) से व्यक्त करते है।
मोललता (m) 
मोललता (molality ) (m) = विलेय के मोलों की संख्या / विलायक का भार ( ग्राम में )
विलेय के मोल = विलेय का भार (ग्राम में ) / अणुभार
मोललता (m) = विलेय का ग्राम में भार / अणुभार x विलायक का भार (kg में)
उदारहण के लिए: 1.00 mol kg–1 (1.00 m) KCl का जलीय विलयन का अर्थ है कि 1 mol (74.5 g) KCl को 1 kg जल में घोला गया है।
द्रव्यमान प्रतिशत, ppm, मोल अंश तथा मोललता ताप पर निर्भर नहीं करते हैं, जबकि मोलरता ताप पर निर्भर करती है। ऐसा इसलिये होता है कि आयतन ताप पर निर्भर करता है जबकि द्रव्यमान नहीं।
Note:
- मोललता की इकाई मोल/kg है।
- मोललता ताप से प्रभावित नहीं होती है क्यूंकि यह आयतन से सम्बंधित नहीं है।
मोललता के सवाल:
Ques: 6 ग्राम यूरिया (NH2-CO-NH2) 500 ग्राम जल में घुला हुआ है तो मोललता ज्ञात कीजिये।
Ans: मोललता (m) = विलेय का ग्राम में भार / अणुभार x विलायक का भार (kg में)
m = 6/60 x 500/1000
m = 0. 2 m या 0. 2 मोल/kg
Ques: 11.1 ग्राम कैल्शियम क्लोराइड ( cacl2 ) 2 किलोग्राम जल में घुला हुआ है तो मोललता ज्ञात करो।
Ans: मोललता (m ) = 11.1 / 111 x 2
m = 1/20
m = 0.5 m
Ques: 4.9 ग्राम सल्फ्यूरिक अम्ल ( H2SO4 ) 250 ग्राम जल में घुला हुआ है तो मोललता ज्ञात करो।
Ans: मोललता (m) = विलेय का ग्राम में भार / अणुभार x विलायक का भार (kg में)
m = 4.9 / 98 x 250/1000
m = 2/10 = 0.2 m
मोलरता और मोललता में अंतर क्या है?
मोलरता और मोललता में अंतर:
मोललता की परिभाषा:
एक किलोग्राम विलायक में किसी विलेय की मोलो की संख्या को मोललता कहते है। इसे m ( small m) से व्यक्त करते है।
मोललता की इकाई मोल/kg है।
एक लीटर विलायक में किसी विलेय की मोलो की संख्या को मोलरता कहते है। इसे M ( Capital M )से व्यक्त करते है।
इसकी इकाई मोल/लीटर होगी।
नीचे दिए गए सूत्र के चित्र में देख सकते है|
मोल अंश | मोल प्रभाज | मोल भिन्न | की परिभाषा
Table of Contents
मोल अंश | मोल प्रभाज | मोल भिन्न की परिभाषा क्या है:
मोल अंश या मोल प्रभाज या मोल भिन्न तीनो एक ही है जिन्हें निम्न प्रकार परिभाषित किया जाता है
विलयन में किसी घटक के मोलो की संख्या तथा विलयन में उपस्थित कुल मोलो की संख्या के अनुपात को उस घटक के मोल अंश या मोल भिन्न या मोल प्रभाज कहते है।
इसे X द्वारा प्रदर्शित किया जाता है।
माना किसी मिश्रण में एक पदार्थ के मोल A है तथा इस मिश्रण में कुल मोल T है तो परिभाषा के अनुसार मोल अंश को निम्न प्रकार प्रदर्शित किया जाता है –
X = A/T
कभी कभी मिश्रण या विलयन के कुल मोल ज्ञात करने के लिए सभी अलग अलग पदार्थों के मोल का योग किया जाता है जिससे मिलकर वह मिश्रण बना हुआ है।
विलेय का मोल अंश = विलेय के मोल/विलयन का कुल मोल
विलायक का मोल अंश = विलायक के मोल/विलयन के कुल मोल
यहाँ याद रखे की विलयन के कुल मोल का मान विलेय तथा विलायक के मोलों का योग करके प्राप्त होती है।
विलेय के मोल अंश + विलायक के मोल अंश = 1
किसी विलयन का मिश्रण में उपस्थित सभी पदार्थों के मोल अंश का योग का मान 1 के बराबर होता है।
माना एक विलयन में दो घटक A तथा B उपस्थित है , इसके मोलो की संख्या क्रमशः na व nb है। तथा मोल अंश क्रमशः xaव xb है।
घटक A के मोल अंश xa = na / na + nb
घटक B के मोल अंश xb = nb / na + nb
जहा xa + xb = 1
उदाहरण के लिए:
–>CCl4 के 3.47 मोल , बेंजीन के 8.54 मोल में घुले हुए है तो CCl4 का मोल अंश क्या होगा ? ज्ञात कीजिये।
विलयन के कुल मोल = CCl4 के मोल + बेंजीन के मोल
विलयन के कुल मोल = 3.47 + 8.54 = 12.01
CCl4 का मोल अंश = CCl4 के मोल/विलयन के कुल मोल
मोल अंश = 3.47/12.01
CCl4 का मोल अंश = 0.2889
मोल प्रतिशत (mole percent) क्या है – mol pratishtha ki paribhasha in hindi :
जब किसी पदार्थ के मोल अंश के मान को 100 से गुणा कर दिया जाए तो उस पदार्थ का मोल प्रतिशत प्राप्त होता है।
मोल प्रतिशत = मोल अंश x 100
चूँकि मोल अंश = पदार्थ के मोल/विलयन के कुल मोल
अत:
मोल प्रतिशत = (पदार्थ के मोल/विलयन के कुल मोल) x 100
द्रव्यमान प्रतिशत (W/W %), आयतन प्रतिशत (v/v %), द्रव्यमान आयतन प्रतिशत (w/v%)
Table of Contents
द्रव्यमान प्रतिशत की परिभाषा क्या है :
100 ग्राम विलयन में किसी विलेय की घुली हुई ग्राम (gm ) में मात्रा को द्रव्यमान प्रतिशत कहते है।
विलयन के अवयव का द्रव्यमान प्रतिशत (%) 
उदाहरण के लिए :
1. यदि एक 100 ग्राम विलयन में चीनी की मात्रा 20 ग्राम तथा जल की मात्रा 80 ग्राम है, तो इस विलयन की सान्द्रता को जल मे 20% द्रव्यमान के रूप में व्यक्त या परिभाषित किया जाता है।
2. यदि एक 1000 ग्राम विलयन में ग्लूकोज की मात्रा 100 ग्राम तथा जल की मात्रा 900 ग्राम है, तो इस विलयन की द्रव्यमान प्रतिशत सान्द्रता 10% होगी।
आयतन प्रतिशत की परिभाषा क्या है:
100 ml (मिलीलीटर ) विलयन में किसी विलेय की घुली हुई ml (मिलीलीटर ) में मात्रा को आयतन प्रतिशत कहते है।
अवयव का प्रतिशत आयतन (V/V) 
द्रवीय विलयन की सान्द्रता को प्राय: आयतन प्रतिशत (आयतन/आयतन) में व्यक्ति या परिभाषित किया जाता है। जैसे वाहन में डाला जाने वाला कूलेंट (एक द्रवीय विलयन जो वाहन के ईंजन को ठंढ़ा रखता है) एथिलीन ग्लाइकॉल का जल में 35% (V/V) विलयन होता है। इस सान्द्रता पर हिमरोधील जल के हिमांक को 255.4 K (–17.5 0C) तक कम कर देता है।
द्रव्यमान आयतन प्रतिशत की परिभाषा क्या है:
100 ml विलयन में किसी विलेय की घुली हुई ग्राम में मात्रा को द्रव्यमान आयतन प्रतिशत कहते है।
द्रव्यमान आयतन प्रतिशत = (विलेय का ग्राम में भार / विलयन का आयतन ml में ) x 100
विलयन की सान्द्रता द्रव्यमान आयतन प्रतिशत में इकाई (मात्रक) औषधियों तथा फार्मेसी में उपयोग में आती है।
PPM (Parts Per Million ) पीपीएम परिभाषा | सूत्र | उदाहरण
Table of Contents
पीपीएम परिभाषाक्या है –
106 ग्राम विलयन में किसी विलेय की घुली हुई gm में मात्रा को PPM (पीपीएम) कहते है।
अर्थात
किसी विलेय पदार्थ के भार भागों की वह संख्या जो विलयन के 10 लाख भार भागों में उपस्थित हो , उसे पीपीएम या पार्ट्स प्रति मिलियन कहा जाता है।
पार्ट्स पर (प्रति) मिलियन 
जल अथवा वायुमंडल में प्रदूषकों की सान्द्रता को प्राय: μ g mL–1 अथवा ppm में व्यक्त किया जाता है।
पीपीएम सांद्रता विधि तब उपयोग की जाती है जब किसी विलयन में विलेय की मात्रा बहुत कम उपस्थित रहती है। अर्थात जब विलयन में किसी पदार्थ की मात्रा बहुत कम घुली हुई रहती है उस स्थिति में विलयन की सान्द्रता को निम्न विधि द्वारा प्रदर्शित किया जाता है।
इसे मिली ग्राम प्रति लीटर की फॉर्म में भी व्यक्त किया जा सकता है अर्थात जब एक लीटर विलयन में एक मिली ग्राम किसी पदार्थ की मात्रा घुली हुई हो तो विलयन की सांद्रता को 1 पीपीएम कहा जा सकता है।
पीपीएम का फुल फॉर्म क्या होता है:
पीपीएम का फुल फॉर्म parts per million है |
ठोस की द्रव में विलेयता तथा प्रभावित करने वाले कारक
Table of Contents
ठोस की द्रव में विलेयता किसे कहते है:
निश्चित ताप पर 100 ग्राम विलायक में किसी ठोस की खुली हुई वह अधिकतम मात्रा जिसे संतृप्त विलयन बनाया जा सके , वह ठोस की द्रव में विलेयता कहलाती है।
संतृप्त विलयन किसे कहते है:
- दिये गये ताप एवं दाब पर जब किसी विलयन में विलेय की और अधिक मात्रा नहीं घोली जा सके, तो ऐसा विलयन संतृप्त विलयन कहलाता है।
- वह विलयन जो बिना घुले विलेय के साथ गतिक साम्य में होता है, संतृप्त विलयन कहलाता है।
संतृप्त विलयन में विलायक की दी गई मात्रा में घुली हुई, विलेय की अधिकत मात्रा होती है। संतृप्त विलयन में विलेय की सान्द्रता उसकी विलेयता कहलाती है।
असंतृप्त विलयन किसे कहते है:
जब ठोस अधिकतम मात्रा से कम मात्रा में घुला हुआ हो तो इस प्रकार बने विलयन को असंतृप्त विलयन कहते है।
अतिसंतृप्त विलयन किसे कहते है:
जब ठोस कुछ अधिकतम मात्रा में घुला हुआ हो तो इस प्रकार बने विलयन को अतिसंतृप्त विलयन कहते है।
ठोसों की द्रव में विलेयता को प्रभावित करने वाले कारक :
विलेय तथा विलायक की प्रकृति :
समान समान को खोलता है , अतः आयनिक ठोस जैसे NaCl , KCl , Na2CO3 , आदि जल जैसे ध्रुवीय विलायकों में खुल जाते है , जबकि सहसंयोजक ठोस जैसे नैफ्थेलिन , एन्थ्रासीन आदि अध्रुवीय विलायको जैसे बेंजीन , CCl4
आदि में खुल जाते है।
- ताप :
वे ठोस जिन्हे जल में खोलने पर ऊष्मा बाहर निकलती है , उनकी विलेयता ताप बढ़ाने से काम हो जाती है , जैसे CaO , Na2CO3 आदि।
वे ठोस प्रदार्थ जिन्हे जल में खोलने पर ऊष्मा अवशोषित होती है उनकी विलेयता ताप बढ़ाने से अधिक हो जाती है जैसे NaCl , KCl , NH4Cl आदि।
- दाब
ठोस तथा द्रव में सम्पीडियता का गुण बहुत कम होता है , अतः ठोस की द्रव में विलेयता पर दाब का कोई प्रभाव नहीं होता।
विलीनीकरण किसे कहते है:
जब एक ठोस विलेय को द्रवीय विलायक में डाला जाता है, तो यह उसमें घुलने लगता है। यह प्रक्रिया विलीनीकरण (घुलना) कहलाती है।
दूसरे शब्दों में किसी ठोस विलेय की एक द्रव विलायक में घुलने की प्रक्रिया विलीनीकरण कहलाती है। विलीनीकरण को अंग्रेजी में डिसाल्यूशन कहते हैं।
क्रिस्टलीकरण किसे कहते है:
विलीनीकरण के क्रम में जब एक ठोस विलेय को द्रवीय विलायक में डाला जाता है, तो ठोस घुलने लगता है जिससे विलयन में विलेय की सान्द्रता बढ़ने लगती है। इसी समय विलयन में से विलेय के कुछ कण ठोस विलेय के कणों के साथ जुड़कर अलग हो जाते हैं। यह प्रक्रिया क्रिस्टलीकरण (Crystalization) कहलाती है।
अत: ठोस विलेय के द्रवीय विलयन में घुलनीकरण के क्रम में विलेय के कुछ कणों का ठोस विलेय के कणों के अलग होकर जुड़ने के प्रक्रिया क्रिस्टलीकरण कहलाती है।
हेनरी का नियम क्या है | सूत्र | अनुप्रयोग
Table of Contents
हेनरी का नियम क्या है – henry ka niyam samjhaiye:
गैस की विलायक में विलेयता तथा दाब मे बीच मात्रात्मक संबंध सर्वप्रथम अंग्रेज रसायनशास्त्री हेनरी ने बतलाया। हेनरी द्वारा बतलाये गये संबंध को हेनरी का नियम कहते हैं।
हेनरी के नियम के अनुसार स्थिर ताप पर किसी गैस की द्रव में विलेयता गैस के दाब के समानुपाती होती है।
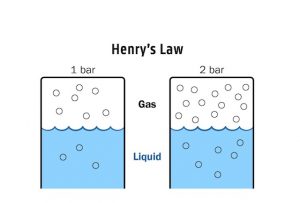
विशेष:
- अक्रिय गैसों के लिए हेनरी नियतांक का मान अधिक होता है अतः अक्रिय गैस कम घुलती है।
- ताप बढ़ाने से हेनरी नियतांक बढ़ता है , k का मान बढ़ने से गैसों की द्रव में विलेयता कम हो जाती है। अतः जलीय जन्तु गर्म जल की तुलना में ठन्डे जल में अधिक सुविधा जनक स्थिति में रहते है , क्यूँकि ठन्डे जल में ऑक्सीजन अधिक घुलती है।
यदि विलयन में गैस के मोल अंश को उसकी विलेयता का माप मानें तो यह कहा जा सकता है कि किसी विलयन में गैस का मोल अंश उस विलयन के ऊपर उपस्थित गैस के आंशिक दाब के समानुपाती होता है।
अत: सामान्य रूप से हेनरी के नियम के अनुसार किसी गैस का वाष्प अवस्था में आंशिक दाब (p), उस विलयन में गैस के मोल अंश (x) के समानुपाती होता है।
अथवा p=KHx – – – – – – – (i)
यहाँ KH हेनरी स्थिरांक है तथा p आंशिक दाब एवं x मोल अंश है।
समीकरण (i) के अनुसार दिए गये दाब पर KH का मान जितना अधिक होगा, द्रव में गैस की विलेयता उतनी ही कम होगी।
गैस के आंशिक दाब तथा विलयन में गैस के मोल अंश के बीच ग्राफ (आलेख)
सामान्य ताप पर विभिन्न गैसों के लिए KH का मान भिन्न भिन्न होता है, अर्थात KH का मान गैस की प्रकृति पर निर्भर करता है।
हेनरी के नियम के अनुप्रयोग:
1. उच्च पहाड़ी स्थानों पर वायु में ऑक्सीजन की मात्रा कम होती है जिससे वायु दाब भी कम होता है जिससे रक्त में ऑक्सीजन गैस कम मात्रा में विलेय होती है , शरीर कमज़ोर होने लगता है , स्पष्ट सोचने की क्षमता कम होने लगती है इस लक्षण को एनोक्सिया कहते है।
2. चूँकि दाब बढ़ने पर द्रव में गैस की विलेयता बढ़ती है इसलिए सोडा जल तथा शीतल पेय में CO2 की विलेयता बढ़ाने के लिए बोतल को अधिक दाब पर बंद किया जाता है।
3. सोडा वाटर या शीतल पेय पदार्थो में कार्बन डाई ऑक्साइड की विलेयता को बढ़ाने के लिए उच्च ताप पर कार्बन डाई ऑक्साइड गैस प्रवाहित करते है।
4. जब समुद्री गोताखोर गहरे समुद्र में जाते है तो उन्हें उच्च दाब का सामना करना पड़ता है जिससे वायु में उपस्थित ऑक्सीजन और नाइट्रोजन की रक्त में विलेयता बढ़ जाती है जब गोताखोर समुद्र की सतह पर आते है तो दाब धीरे धीरे कम होने लगता है , दाब कम होने पर रक्त में घुली ऑक्सीजन और नाइट्रोजन गैस बुलबुलों के रूप में रुधिर कोशिकाओं में एकत्रित होने लगती है जिससे रक्त के प्रवाह में रुकावट आती है यह स्थिति घातक होती है इसे बेंटस कहते है , इससे बचने के लिए वायु में काम घुलनशील गैसे जैसे हीलियम और निऑन मिलायी जाती है।
राउल्ट का नियम क्या है | समीकरण सूत्र
Table of Contents
राउल्ट का नियम क्या है – rault ka niyam:
राउल्ट नियम के अनुसार वाष्पशील द्रवों के विलयन में प्रत्येक अवयव का आंशिक दाब विलयन में उसके मोल अंश के समानुपाती होता है।
मान लिया कि एक बंद पात्र में द्रव 1 और 2 का एक द्विअंगी (बाइनरी) विलयन है।
मान लिया कि द्रव 1 का आंशिक दाब =p1 तथा द्रव 2 का आंशिक दाब =p2 है।
मान लिया लिये गये विलयन का का साम्य अवस्था में कुल वाष्प दाब =pt है।
तथा विलयन के दोनों अवयवों का मोल अंश क्रमश: x2 तथा x2 हैं।
अत: राउल्ट के नियम के अनुसार,
विलयन के अवयव 1 के लिए p1∝x1
⇒p1=p1ox1 – – – – – (i)
उसी प्रकार, विलयन के अवयव 2 के लिए
p2∝x2
⇒p2=p2ox2 – – – – – (ii)
जहाँ p1 और p2 विलयन 1 तथा 2 के शुद्ध अवयवों का क्रमश: आंशिक वाष्प दाब है।
अब, डाल्टन के आंशिक दाब के नियम के अनुसार पात्र में विलयन अवस्था का कुल दाब (pt) विलयनों के अवयवों के आंशिक दाब के जोड़ के बराबर होता है।
अर्थात,
अत: समीकरण (1) तथा समीकरण (2) से
pt=p1ox1+p2ox2
[∵ x1+x2=1, ∴ x1=1-x2]
∴Pt=(1-x2)p1o+x2p2o
⇒pt=p1o–p1ox2 + x_2 p_2^o`
⇒pt=p1o–x2(p1o–p2o)
⇒pt=p1o+(p2o+P1o)x2 – – – – (iii)
उसी प्रकार, ∵ x2=1–x1
अत: pt=p2o+(p1o+p2o)x1 – – – – (iv)
अत: समीकरण (iii) तथा (iv) से कहा जा सकता है कि
(i) किसी विलयन के कुल वाष्प दाब को उसके किसी अवयव के मोल अंश से संबंधित किया जा सकता है।
(ii) किसी विलयन का कुल वाष्प दाब अवयव 2 के मोल अंश के साथ रेखीय रूप से परिवर्तित होता है।
(iii) शुद्ध अवयव 1 एवं 2 के वाष्प दाब पर निर्भर रहते हुए विलयन का कुल वाष्प दाब अवयव 1 के मोल अंश के बढ़ने से कमा या ज्यादा होता है।
किसी विलयन के लिए आंशिक दाब p1 या p2 का x1 तथा x2 के विरूद्ध आलेख (ग्राफ):
किसी विलयन के लिए आंशिक दाब p1 या p2 का x1 तथा x2 के विरूद्ध आलेख (ग्राफ) रेखीय (सरल रेखा) होता है।
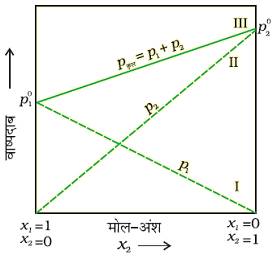
जब x1 का मान 1 होता है तो रेखा I बिन्दुअ p1o से होकर गुजरती है।
जब x2 का मान 1 होता है तो रेखा II बिन्दुअ p2o से होकर गुजरती है।
उसी प्रकार pt का x2 के विरूद्ध खींचा गया ग्राफ रेखा III भी रेखीय अर्थात एक सरल रेखा होता है।
pt का न्यूनतम मान p1o तथा अधिकत मान p2o है। यहाँ पर विलयन के अवयव 1 अवयव 2 की तुलना में कम वाष्पशेल है। अर्थात,
अनादर्श विलयन धनात्मक विचलन तथा ऋणात्मक विचलन में अंतर
अनादर्श विलयन दो प्रकार के होते है।
- धनात्मक विचलन (positive deviations )
- ऋणात्मक विचलन (negative deviations )
| धनात्मक विचलन | ऋणात्मक विचलन |
| 1. ये राउल्ट के नियम से धनात्मक विचलन दर्शाते है। अर्थात P1 > P10 X1 P2 > P20 X2 P > P10 X1 + P20 X2 | ये राउल्ट नियम से ऋणात्मक विचलन दर्शाते है। अर्थात P1 < P10 X1 P2 < P20 X2 P < P10 X1 + P20 X2 |
| 2. विलयन का आयतन विलेय तथा विलायक के कुल आयतन से अधिक होता है। अर्थात ΔVमिश्रण = +ve | विलयन का आयतन विलेय तथा विलायक के कुल आयतन से कम होता है। अर्थात ΔVमिश्रण = -ve |
| 3. विलेय तथा विलायक को मिलाने पर ऊष्मा अवशोषित होती है। अर्थात ΔHमिश्रण = +ve | विलेय तथा विलायक को मिलाने पर ऊष्मा उत्सर्जित होती है। अर्थात ΔHमिश्रण = -ve |
| 4. विलयन के घटको के मध्य आकर्षण शुद्ध घटको की तुलना में कम होता है। उदाहरण – C2H5OH + H2O | विलयन के घटको के मध्य आकर्षण शुद्ध घटको की तुलना में अधिक होता है। उदाहरण -CHCl3 |
अणु संख्यक गुण वाष्पदाब का आपेक्षिक अवनमन
अणु संख्य गुण:
किसी विलयन के वे भौतिक गुण जो इकाई आयतन में उपस्थित विलेय के कणों की संख्या पर निर्भर करते है न की उनकी प्रकृति पर , उन्हें अणु संख्य गुण कहते है।
ये निम्न है।
- वाष्पदाब का आपेक्षिक अवनमन
- क्वथनांक में उन्नमन
- हिमांक
- परासरण दाब
- वाष्पदाब का आपेक्षिक अवनमन
जब किसी शुद्ध विलायक में अवाष्पशील विलेय घोला जाता है तो उसका वाष्प दाब कम हो जाता है , अर्थात विलयन का वाष्पदाब शुद्ध विलायक से कम होता है , इसे वाष्पदाब में अवनमन कहते है।
राउल्ट ने अवाष्पशील विलेय युक्त विलयनों के लिए राउल्ट नियम दिया , जिसके अनुसार
जब किसी शुद्ध विलायक में अवाष्पशील विलेय घोला जाता है तो वाष्पदाब का आपेक्षिक अवनमन विलेय के मोल अंश के बराबर होता है।
अवाष्पशील विलेय द्वारा शुद्ध विलायक के वाष्पदाब में अवनमन तथा शुद्ध विलायक के वाष्पदाब के अनुपात – को वाष्पदाब का आपेक्षिक अवनमन कहते है।
माना शुद्ध विलायक व विलयन के वाष्पदाब क्रमशः P10 तथा P1 है। अतः
वाष्पदाब का आपेक्षिक अवनमन = (P10 – P1 ) / P10
माना किसी विलयन में विलायक व विलेय के मोलों की संख्या क्रमशः n1 व n2 है।
तथा उनके मोल अंश क्रमशः X1 व X2 है तो विलेय के मोल
x1 = n2 / n1 + n2
राउल्ट नियम से
(P10 – P1 ) / P10 = n2 / n1 + n2
तनु विलयन के लिए n1 >> n2 ≃ n1
(P10 – P1 ) / P10 = n2 / n1
चूँकि n1 = W1 / M1
n2 = W2 / M2
अतः
(P10 – P1 ) / P10 = W2M1 /W1M2
क्वथनांक क्या है | क्वथनांक का उन्नयन | सूत्र
Table of Contents
क्वथनांक किसे कहते है:
वह ताप जिस पर किसी द्रव का वाष्पदाब वायुमण्डलीय दाब के बराबर हो जाता है उस ताप को द्रव का क्वथनांक कहते है।
एक वायुमण्डलीय (atm) या (1.013 ) बार पर शुद्ध जल का क्वथनांक 373.15 k होता है।
विलयन का क्वथनांक शुद्ध विलायक से अधिक होता है क्यों ?
जब किसी शुद्ध विलायक में अवाष्पशील विलेय घोला जाता है तो उसका वाष्पदाब कम हो जाता है अर्थात विलयन का वाष्पदाब शुद्ध विलायक से कम होता है , विलयन के वाष्पदाब के वायुमण्डलीय दाब के बराबर रखने के लिए विलयन को और अधिक गर्म करना पड़ता है।
अतः विलयन का क्वथनांक शुद्ध विलायक से अधिक होता है इसे क्वथनांक में उन्नयन कहते है।
माना शुद्ध विलायक व विलयन के क्वथनांक क्रमशःTb व T1 है। तो क्वथनांक में उन्नयन
ΔTb = Tb – T1
क्वथनांक का उन्नयन:
हिमांक व गलनांक किसे कहते है | परिभाषा | सूत्र
Table of Contents
हिमांक किसे कहते है – himank kise kahte hai:
वह ताप जिस पर किसी द्रव की द्रव व ठोस दोनों अवस्थाओं का वाष्पदाब समान हो जाता है। वह द्रव का हिमांक कहलाता है।
शुद्ध जल का हिमांक 0 डिग्री सेंटीग्रेट या 273 केल्विन होता है।
गलनांक किसे कहते है:
वह निश्चित ताप, जिस पर सम्पूर्ण ठोस ऊष्मा ग्रहण कर द्रव में बदल जाता है, उसे ठोस का गलनांक कहते हैं। बर्फ का गलनांक वायुमण्डलीय दाब पर 0°C है।
- अवाष्पशील विलेय युक्त विलयन का हिमांक शुद्ध विलायक से कम होता है क्यों ?
जब किसी शुद्ध विलायक में अवाष्पशील विलेय घोला जाता है तो उसका वाष्पदाब कम हो जाता है अर्थात विलयन का वाष्पदाब शुद्ध विलायक से से कम होता है वाष्पदाब कम होने पर विलयन का हिमांक और भी कम हो जाता है। इसे हिमांक में अवनमन कहते है।
माना शुद्ध विलायक व विलयन के हिमांक क्रमशः Tf व T1 है। तो हिमांक में अवनमन
ΔTb = Tf – T1
- विलायक तथा विलयन के लिए वाष्पदाब ताप वक्र खींचते हुए स्पष्ट कीजिये कि विलयन का हिमांक शुद्ध विलायक से कम होता है।
जब किसी शुद्ध विलायक में अवाष्पशील विलेय घोला जाता है तो विलयन का वाष्पदाब शुद्ध विलायक की तुलना में कम होता है जिससे विलयन शुद्ध विलायक की तुलना में कम ताप पर जमता है। अर्थात विलयन का हिमांक शुद्ध विलायक से कम होता है। इसे हिमांक में अवनमन कहते है।
माना शुद्ध विलायक व विलयन के हिमांक क्रमशः Tf व T1 है।
तो
ΔTb = Tf – T1
ΔTb = 273 – 272 = 1k
विसरण तथा परासरण क्या है | परिभाषा | सूत्र
Table of Contents
विसरण किसे कहते है: – visran kya hai:
पदार्थ के अणु अधिक सान्द्रता वाले क्षेत्र से कम सांद्रता वाले क्षेत्र की ओर स्वतः ही गति करते है जब तक की सभी जगह सान्द्रता समान न हो जाये।
उदाहरण : जल में स्याही की बून्द डालने पर समांगी विलयन का बनना।
परासरण किसे कहते है: – prasaran kya hota hai:
अर्द्ध पारगम्य छिल्ली द्वारा जल के अणुओं कम सान्द्रता वाले विलयन से अधिक सांद्रता वाले विलयन की ओर जाना परासरण कहलाता है।
एक U आकार की काँच की नाली के मध्य में अर्द्ध पारगम्य छिल्ली व्यवस्थित करके उसमे एक तरफ जल व दूसरी तरफ विलयन भर लेते है। जल तथा विलयन की सतह पर जल रोधी पिस्टन लगे होते है। परासरण की क्रिया द्वारा जल के अणु शुद्ध जल से विलयन की ओर प्रवेश करते है जिससे विलयन की सतह पर लगा पिस्टन ऊपर की ओर सरकने लगता है। इस पिस्टन के पुन: उसी अवस्था में लाने के लिए विलयन की सतह पर जो दाब डाला है उसे परासरण दाब कहते है।
अतः अर्द्ध पारगम्य छिल्ली द्वारा जल के अणुओं का विलायक से विलयन में प्रवेश करने के लिए विलयन की सतह पर जो दाब डाला जाता है उसे परासरण दाब कहते है। इसे π से व्यक्त करते है।
परासरण की क्रिया के प्रकार:
परासरण की क्रिया के दो प्रकार होते हैं |
1. बहि परासरण:
जब किसी कोशिका को उच्च सान्द्रता वाले विलयन में रखा जाता हैं , तो विलायक के अणु कोशिका से बाह्य विलयन में बहि परासरण द्वारा गमन करने लगते हैं | यह क्रिया बहि परासरण कहलाती हैं | इस क्रिया में कोशिका सिकुड़ जाती हैं , जिसे जीवद्रव्य संकुचन ( Plasmolysis ) भी कहते हैं |
2. अंतः परासरण:
जब किसी कोशिका को निम्न सान्द्रता वाले विलयन रखा जाता हैं , तो विलायक के अणु कोशिका के अंदर अंतः परासरण द्वारा गमन करने लगते हैं | इस क्रिया को अंतः परासरण कहते हैं | इसमें कोशिका फूल जाती हैं , जिससे इसे जीवद्रव्य विकुंचन भी कहते हैं |
उदाहरण – किशमिश का फूलना ( पानी मे रखने पर ) |
अर्द्ध पारगम्य झिल्ली क्या है | उदाहरण
Table of Contents
अर्द्ध पारगम्य झिल्ली क्या है:
यह एक ऐसी परत होती है जो केवल विलायक के कणों को गुजरने देती है लेकिन विलेय के कणों या अणुओं को इससे होकर गुजरने नहीं देती है।
अर्थात अर्द्ध पारगम्य झिल्ली एक प्रकार की जैविक या कृत्रिम झिल्ली या परत होती है जो केवल इससे कुछ विशेष प्रकार के अणुओं , आयनों या कणों को गुजरने देती है बाकी अन्य कणों को रोक देती है या गुजरने नहीं देती है।
यह एक सतत शिट की तरह होती है , अर्धपारगम्य झिल्ली में विशेष छिद्र होते है जो केवल कुछ विशेष कणों या अणुओं को इनसे होकर गुजरने देते है और जो कण इन छिद्रों के अनुरूप नहीं होते है वे कण अर्धपारगम्य झिल्ली से होकर नहीं गुजर पाते है इसलिए इस झिल्ली से केवल विलायक के कण आसानी से गुजर जाते है लेकिन विलेय के कण इससे होकर नहीं गुजर सकते है।
जैसा कि हमने ऊपर पढ़ा कि अर्धपारगम्य झिल्ली जैविक या प्राकृतिक , किसी भी प्रकार की हो सकती है , जैविक झिल्ली वह होती है जो जीवों में प्राकृतिक रूप से पायी जाती है जैसे हमारे शरीर कई प्रकार की झिल्ली पायी जाती है जैसे रक्त को शुद्ध करने के लिए भी एक विशेष प्रकार की झिल्ली पायी जाती है जो केवल रक्त के शुद्ध कणों को गुजरने देती है लेकिन इसमें अन्य कणों को गुजरने से रोक देती है जिससे रक्त शुद्ध हो जाता है।
अर्द्ध पारगम्य झिल्ली उदाहरण :
चित्र में किडनी में अर्द्ध पारगम्य झिल्ली को दर्शाया गया है:
यहाँ पीले रंग में झिल्ली को दिखाया गया है जो किडनी में कार्य कर रही है उसके समान है , यह प्राकृतिक या जैविक प्रकार की झिल्ली है।
यह झिल्ली लाल रुधिर के कणों को इससे गुजरने नहीं देती है लेकिन अवांछित कणों को इससे गुजरने देती है जिससे रुधिर शुद्ध हो जाता है और किडनी जब इन अवांछित कणों की सांद्रता अधिक हो जाती है तो यूरिन या पेशाब बनता है जिसमें अवांछित कण यूरिया होता है।
परासरण और विसरण में अन्तर
परासरण :
विलायक का कम सान्द्रता के विलयन से अधिक सान्द्रता के विलयन की ओर अर्द्धपारगम्य झिल्ली में से होकर स्वतः प्रवाह करते हैं , परासरण कहलाता है ।
विसरण :
वह क्रियाविधि जिसमें विलेय के अणु या कण विलयन में जाकर उसके सभी भागों की सान्द्रता को समान कर देते हैं , विसरण कहलाता है ।
परासरण तथा विसरण में अन्तर :
(1) परासरण में अर्द्धपारगम्य झिल्ली का होना आवश्यक होता है । जबकि विसरण में किसी भी प्रकार की झिल्ली की आवश्कता नहीं होती है ।
(2) परासरण में कणों का प्रवाह केवल एक दिशा में होता है , अर्थात् केवल विलायक के कण गति करते हैं , जबकि विसरण में विलायक और विलेय दोनों कण विपरीत दिशाओं में गति करते हैं ।(3) परासरण में विलायक के कण कम सान्द्रता वाले विलयन से अधिक सान्द्रता वाले विलयन की ओर प्रवाहित होते हैँ , जबकि विसरण में कणों का प्रवाह अधिक सान्द्रता से कम सान्द्रता की ओर होता है ।
Note:
- दो समान सान्द्रता वाले विलयनों का परासरण दाब समान होता है। इन्हें सम परासरी विलयन कहते है।
- दो अलग अलग सान्द्रता वाले विलयनों में से वह विलयन जिसका परासरण दाब अधिक होता है उसे अति परासरी कहते है। तथा वह विलय जिसका परासरण दाब कम होता है उसे hypotonic solution (अल्प परासरी ) विलयन कहते है।
असामान्य मोलर द्रव्यमान क्या है?
ऐसे मोलर द्रव्यमान जो सामान्य मोलर द्रव्यमान की तुलना में अधिक या कम प्राप्त होते है उन्हें विलेय पदार्थ का असामान्य मोलर द्रव्यमान कहते है , यह विलेय पदार्थ के विलयन में संगुणन या आयनन के कारण होता है।
वांट हॉफ ने एक वांटहॉफ गुणांक का प्रतिपादन किया , इस गुणांक की सहायता से विलेय के संगुणन या आयनन की मात्रा को ज्ञात किया जा सकता है।
वांट हॉफ गुणांक को i द्वारा व्यक्त करते है।
i = प्रेक्षित अणु संख्यक गुण/सैधांतिक अणुसंख्यक गुण
यदि वांट हॉफ गुणांक (i) का मान 1 प्राप्त होता है तो मतलब विलेय का संगुणन या आयनन नहीं हुआ है।
जब वांट हॉफ (i) का मान एक से अधिक प्राप्त हुआ है तो विलेय का आयनन या वियोजन हुआ है।
जब वांटहॉफ (i) का मान एक से कम आता है तो इस स्थिति में विलेय का संगुणन हुआ है।
वांट हॉफ को सम्मिलित करने के बाद , अणु संख्यक गुणों के समीकरण द्वारा विलेय का सही मोलर द्रव्यमान ज्ञात किया जा सकता है।
वान्ट हाफ गुणांक सम्मिलित करने के बाद , अणु संख्यक गुण की समीकरण निम्न प्रकार प्राप्त होती है –
वान्ट हॉफ गुणांक परिभाषा क्या है | सूत्र
वान्ट हॉफ गुणांक किसे कहते है:
असामान्य मानो की व्याख्या करने के लिए वान्टहॉफ ने एक नए गुणांक का समावेश किया जिसे वान्टहॉफ गुणांक कहते है इसे i से व्यक्त करते है।
विलेय के प्रेक्षित मोल तथा सैद्धांतिक मोल के अनुपात को वान्टहॉफ गुणांक कहते है।
वान्टहॉफ गुणांक (i ) = विलेय के प्रेक्षित मोल / विलेय के सैद्धांतिक मोल
i = विलेय के प्रेक्षित अणु संख्यक गुण / विलेय के सैद्धांतिक अणु संख्य गुण
i = (ΔP/P10)0 /( ΔP/P10)t
i = (ΔTb)प्रेक्षित /( ΔTb)सैधांतिक
i = (ΔTf )0 /( ΔTf)t
i = Π0/ Πt
अणु संख्य गुणों के सभी मान विलेय के अणुभार के व्युत्क्रमानुपाती होते है।
अतः
i = विलेय के सैद्धांतिक अणुभार / विलेय का प्रेक्षित अणुभार





No comments:
Post a Comment